Oxidation: Der Dreh mit dem Spin
Quantenmechanik bestimmt Reaktion von Sauerstoff mit Metallen
Anzeigen
Reaktionen mit Sauerstoff gehören zu den wichtigsten chemischen Prozessen. Nützlich sind sie, wenn Nahrung in Körperzellen oder Erdgas in Kraftwerken kontrolliert zu Kohlendioxid verbrannt wird, um Energie zu gewinnen. Ökologisch problematisch kann es werden, wenn sich mit Luftsauerstoff Ozon oder Stickoxide bilden. Besondere wirtschaftliche und technische Bedeutung hat die sauerstoffabhängige Korrosion von Eisen, der Rost. Obwohl sie so verbreitet ist, weiß man über die atomaren Abläufe bei der Oxidation mit Sauerstoff recht wenig. Licht ins Dunkel bringt nun eine Arbeit von Forschern des Karlsruher Instituts für Technologie (KIT).
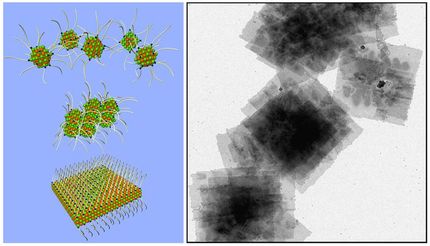
Die Veröffentlichung der Chemiker Professor Hansgeorg Schnöckel und Dr. Ralf Burgert zeigt, dass der Spin, also der Drehimpuls der Elektronen, die für die Bindung zwischen den Atomen verantwortlich sind, bei der Korrosion von Metallen entscheidend ist. Als Modellsystem stellten die Wissenschaftler Nanopartikel aus wenigen Aluminiumatomen her. Für die Untersuchung dieser als Cluster bezeichneten Strukturen nutzten sie die Fourier-Transform-Massenspektrometrie, ein Verfahren, das bisher vor allem bei der Analyse von Proteinen eingesetzt wurde.
In Zusammenarbeit mit amerikanischen Wissenschaftlern aus Baltimore, Lake Charles und Richmond sowie Forschern an der Universität Konstanz konnten die Chemiker nachweisen, dass der Spin bestimmt, ob es zu einer spontanen Oxidation kommt oder nicht. Entscheidend ist, dass die Spins bei beiden Reaktionspartnern zueinander passen, denn nach den "Spin-Auswahlregeln" sind nur bestimmte Kombinationen möglich.
"Eigentlich müsste um uns herum alles brennen, denn unsere Luft enthält 20 Prozent Sauerstoff", erläutert Schnöckel, der am Centrum für Funktionelle Nanostrukturen des KIT arbeitet. "Zum Glück existiert Sauerstoff in unterschiedlichen quantenmechanischen Formen. Aufgrund der Elektronenzustände hat er als Triplett-Sauerstoff, also in seiner 'Normalform', die niedrigste Energie und magnetische Eigenschaften. Nur durch die Zufuhr von Energie, etwa durch UV-Strahlung in den oberen Schichten der Atmosphäre oder durch chemische Reaktionen im Labor, entsteht Singulett-Sauerstoff. Er ist nicht magnetisch und aufgrund seiner höheren Energie sehr instabil."
Schnöckels Team konnte nachweisen, dass nur diese Form spontan, ohne Energiezufuhr, einen hoch stabilen Cluster aus 13 Aluminiumatomen (Al13) oxidiert. Hierfür fingen sie negativ geladene Al13-Cluster im Magnetfeld eines Massenspektrometers auf einer Kreisbahn ein. Durch elektrische Entladungen produzierten sie Singulett-Sauerstoff, der im Hochvakuum des Geräts über längere Zeit stabil ist. Da die Reaktionspartner nur in geringer Konzentration vorliegen, trifft ein Molekül nur etwa alle zehn Sekunden auf einen Aluminium-Cluster - genug Zeit, um den schnellen ersten Reaktionsschritt der Oxidation zu messen. Im gleichen Experiment reagierte ein Cluster mit 14 Aluminiumatomen, der selbst wie ein winziger Magnet wirkt, nicht mit Singulett-, sondern mit Triplett-Sauerstoff.
Bisher hat das Team ausschließlich kleine Aluminium-Cluster untersucht. Ihre regelmäßige Struktur mache sie zu idealen Versuchsobjekten, so Schnöckel. "Vereinfacht gesagt verhalten sich Al13-Cluster wie Aluminium-Metall." Seine Untersuchungen und Methoden können aber auch auf andere Reaktionen mit Sauerstoff, wie sie etwa bei Verbrennungsvorgängen oder bei der Zersetzung von Kunststoffen auftreten, übertragen werden, um sie besser zu verstehen und kontrollieren zu können.
Ein negativ geladener Al13-Cluster mit seiner stabilen Elektronenstruktur reagiert nur langsam mit einem Sauerstoff-Molekül im Triplett-Zustand (rot). Das Molekül verhält sich aufgrund der Drehrichtung seiner Elektronen (Spin) wie ein kleiner Magnet und ist nur eingeschränkt reaktionsfähig.
Der Elektronenspin beim nicht-magnetischen Singulett-Sauerstoffmolekül (rot) erlaubt eine schnelle Bindung an das negativ geladene Al13-Ion. In einem Zwischenschritt verformt sich der Cluster, der am Ende der Oxidationsreaktion in zwei Moleküle Aluminiumoxid und ein instabiles Al9-Ion zerfällt.
Originalveröffentlichung: R. Burgert et al.;"Spin Conservation Accounts for Aluminum Cluster Anion Reactivity Pattern with O2."; Science 2008, 319 (5862), 438-442.
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!