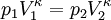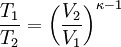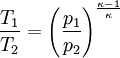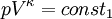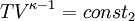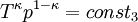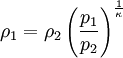Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Adiabatische ZustandsänderungEine adiabatische (auch: adiabate; griech. α [a] – nicht, διαβαίνειν [diabaínein] – hindurchgehen) Zustandsänderung ist ein thermodynamischer Vorgang, bei dem ein System von einem Zustand in einen Anderen überführt wird, ohne Wärmeenergie mit seiner Umgebung auszutauschen. Produkt-Highlight
BedeutungIm Allgemeinen kann ein thermodynamisches System seine innere Energie U verändern, indem es sowohl (mechanische oder anders geartete) Arbeit δW als auch Wärme δQ mit seiner Umgebung austauscht. Nach dem ersten Hauptsatz der Thermodynamik gilt dabei für ein geschlossenes System, wenn äußere Energien (kinetische und potentielle) außer Betracht bleiben können:
Bei einer adiabatischen Zustandsänderung findet kein Wärmeaustausch mit der Umgebung statt (δQ = 0), so dass die gesamte am System verrichtete Arbeit vollständig in die innere Energie übergeht oder ein Teil der inneren Energie vollständig in Arbeit umgewandelt wird, die vom System geleistet wird:
(Erster Hauptsatz für ein adiabates geschlossenes und ruhendes System)
Berechnungen und theoretische Überlegungen können dadurch stark vereinfacht oder unter Umständen erst ermöglicht werden. Es sind sowohl irreversibel als auch reversibel ablaufende adiabatische Zustandsänderungen möglich. Im ersten Fall wird im System während des Vorgangs Entropie erzeugt, im letzten Fall nicht. Weil keine Wärmeenergie mit der Umgebung ausgetauscht wird, fließt auch keine Entropie zu oder ab. Ist die Zustandsänderung reversibel, so bleibt die Entropie des Systems daher gleich, es handelt sich dann um eine isentrope Zustandsänderung. (Das Umgekehrte gilt nicht: eine isentrope Zustandsänderung kann auch irreversibel und diabatisch sein, wenn exakt die erzeugte Entropie nach außen abfließt; ein weiteres Gegenbeispiel ist das Verhalten bei Annäherung an den absoluten Temperaturnullpunkt: Hier sind die Zustandsänderungen wegen des 3. Hauptsatzes der Thermodynamik (fast) immer isentropisch, aber nur in Ausnahmefällen adiabatisch). Reversible adiabatische Zustandsänderungen spielen ferner eine wichtige Rolle bei der axiomatischen Begründung der Thermodynamik nach Carathéodory. Ausgehend von dem Axiom „Es gibt in der Nähe jedes reversibel erreichbaren Zustandes Zustände, welche nicht adiabatisch-reversibel, also nur irreversibel oder überhaupt nicht erreichbar sind“[1] wird die Existenz einer neuen Zustandsgröße Entropie bewiesen. Zustände, zwischen denen nur irreversible Übergänge möglich sind, unterscheiden sich nämlich in ihrer Entropie, so dass kein adiabatisch-reversibler (also isentroper) Übergang zwischen ihnen existieren kann. Näherungsweise RealisierungEine ideale adiabatische Zustandsänderung setzt voraus, dass das System, in dem die Zustandsänderung stattfindet, perfekt gegen Wärmeströme jeglicher Form isoliert ist. Es wären also Wärmeleitung, konvektive Wärmeübertragung und Strahlungsaustausch vollständig zu unterbinden. Das System darf von einem Wärmestrom durchflossen werden, sofern keine Wärme daraus im System verbleibt; der Wärmstrom kann dann als nicht zum System gehörig betrachtet werden (Beispiele: ein völlig transparentes von der Sonne beschienenes System, ein von nicht wechselwirkenden Neutrinos durchflutetes System). In der Realität ist eine vollständige Wärmeisolation nicht erreichbar, aber reale Vorgänge können in guter Näherung adiabatisch ablaufen, wenn
In der Realität handelt es sich praktisch immer um zumindest partiell diabatische Prozesse, so dass man nur noch näherungsweise von einer adiabatischen Zustandsänderung ausgehen kann. Beispiele
Arbeit bei einer reversiblen adiabaten (isentropen) Zustandsänderung eines idealen GasesIm Falle eines idealen Gases gilt für die innere Energie: Wegen
Hierbei bezeichnen N die Anzahl der Gasteilchen, f die Anzahl der nicht eingefrorenen Freiheitsgrade, kB die Boltzmann-Konstante, T die absolute Temperatur, κ den Isentropenexponenten, n die Stoffmenge (in Mol), NA die Avogadro-Konstante und R die allgemeine Gaskonstante. Damit gilt wegen δW = dU für die bei einer reversiblen adiabatischen (isentropen) Zustandsänderung geleistete Arbeit (Volumenarbeit):
Hierbei bezeichnen T1,2 und V1,2 Anfangs- bzw. Endtemperaturen und -volumina, und cv die molare spezifische Wärme bei konstantem Volumen. Daraus ergibt sich auch, dass die Arbeit des Prozesses mit höherer Temperaturdifferenz T1 − T2 größer wird. Dies hat unter anderem den adiabatischen Temperaturgradienten der unteren Erdatmosphäre zur Folge. Aus der Zustandsgleichung eines idealen Gases folgen diese Zusammenhänge: Diese Gleichungen lassen sich so umformen, dass gilt: Sie werden auch Poissonsche Gleichungen genannt. Da auch die Masse des Gasvolumens konstant bleibt, ist auch die Umformung auf die Änderung der Dichte einfach berechenbar: Siehe auch
Einzelnachweise
|
|
| Dieser Artikel basiert auf dem Artikel Adiabatische_Zustandsänderung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





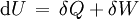
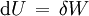
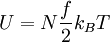
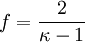 folgt:
folgt:
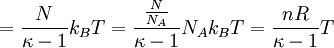 .
.
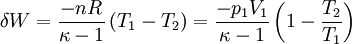
![= {- p_1 V_1 \over \kappa - 1} \left[ 1 - \left({V_1 \over V_2}\right)^{\kappa - 1} \right] = - n c_v \left(T_1 - T_2\right)](images/math/d/9/d/d9daf3b6580265be5e2b701b4609b037.png) .
.