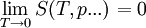Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ThermodynamikDie Thermodynamik, auch als Wärmelehre bezeichnet, ist ein Teilgebiet der klassischen Physik. Sie entstand im Verlauf des 19. Jahrhunderts auf der Grundlage der Arbeiten von James Prescott Joule, Nicolas Léonard Sadi Carnot, Julius Robert von Mayer und Hermann von Helmholtz. Sie ist die Lehre der Energie, ihrer Erscheinungsform und Fähigkeit, Arbeit zu verrichten. Sie erweist sich als vielseitig anwendbar in der Chemie, Biologie und Technik. Mit ihrer Hilfe kann man zum Beispiel erklären, warum bestimmte chemische Reaktionen spontan ablaufen und andere nicht. Die Thermodynamik ist eine rein makroskopische Theorie, in deren Rahmen angenommen wird, dass sich die physikalischen Eigenschaften eines Systems hinreichend gut mit makroskopischen Zustandsgrößen beschreiben lassen. Sie ist eine Effektive Theorie, da sie die Bewegung der einzelnen Atome und Moleküle vernachlässigt und nur mittlere Größen wie Druck und Temperatur betrachtet. Dabei werden intensive Zustandsgrößen, beispielsweise Temperatur T, Druck p und chemisches Potenzial μ, von extensiven Zustandsgrößen, beispielsweise innerer Energie U, Entropie S, Volumen V und Teilchenzahl N, unterschieden. Die Arbeit W und die Wärme Q sind keine Zustandsgrößen, da sie nicht vom Zustand des Systems zu einem gegebenen Zeitpunkt, sondern von seiner gesamten Vorgeschichte abhängen. Die Gleichungen, die konkrete Zusammenhänge zwischen den Zustandsgrößen für spezielle physikalische Systeme (z. B. ideales Gas) liefern, heißen Zustandsgleichungen. Die Thermodynamik kann auf vier Hauptsätzen aufgebaut werden. Diese sind in ihrer ursprünglichen Formulierung - entsprechend ihrer Entstehung auf empirischen Beobachtungen beruhend - reine Erfahrungssätze. Ihre heutige mathematische Struktur erhielt die Thermodynamik durch die Arbeiten von Josiah Willard Gibbs, der als Erster die Bedeutung der Fundamentalgleichung erkannt und ihre Eigenschaften formuliert hat. Im Jahre 1999 wurde von den Physikern Elliott Lieb und Jakob Yngvason eine neue Systematik vorgestellt, bei der die Definition der Entropie auf dem Konzept der adiabatischen Erreichbarkeit beruht und auf einer streng mathematischen Basis in Form von 15 Axiomen steht. Dabei ist die Temperatur nur noch eine aus der Entropie als Grundgröße abgeleitete Größe. Es bleibt abzuwarten, ob diese Theorie in der Praxis Anwendung finden wird (erwähnenswert ist auf jeden Fall, dass schon 1909 von Constantin Carathéodory eine berühmte axiomatische Begründung gegeben wurde). Durch die statistische Mechanik nach James Clerk Maxwell und Ludwig Boltzmann können viele Aspekte der Thermodynamik anhand mikroskopischer Theorien bestätigt werden. In ihrer gesamten Darstellung behält sie allerdings weiterhin den ausgezeichneten Status einer eigenständigen physikalischen Theorie. Ihre Anwendbarkeit muss jedoch auf geeignete Systeme eingeschränkt werden, nämlich solche, die sich aus genügend vielen Einzelsystemen, also meist Teilchen, zusammensetzen.
Produkt-Highlight
Kurze Zusammenfassung der Hauptsätze0. Hauptsatz: Stehen zwei Systeme jeweils mit einem dritten im thermodynamischen Gleichgewicht, so stehen sie auch untereinander im Gleichgewicht. 1. Hauptsatz: Energie kann weder erzeugt noch vernichtet, sondern nur in verschiedene Arten umgewandelt werden. 2. Hauptsatz: Energie ist nicht in beliebigem Maße in andere Arten umwandelbar. 3. Hauptsatz: Der absolute Nullpunkt der Temperatur ist unerreichbar. „Nullter“ Hauptsatz (manchmal auch 4. Hauptsatz genannt)
Wenn ein System A sich mit einem System B sowie B sich mit einem System C im thermischen Gleichgewicht befindet, so befindet sich auch A mit C im thermischen Gleichgewicht. Anders formuliert, das Gleichgewicht ist transitiv. Dies erlaubt es, eine neue Zustandsgröße, die empirische Temperatur θ einzuführen, so dass zwei Systeme genau dann die gleiche Temperatur haben, wenn sie sich im thermischen Gleichgewicht befinden. Dieses Gesetz wurde erst nach den drei anderen Hauptsätzen formuliert. Da es aber eine wichtige Basis bildet, wurde es später als „nullter“ Hauptsatz bezeichnet. Es erklärt, warum ein Thermometer, das in Kontakt mit dem zu messenden Objekt steht, die Temperatur messen kann. Allerdings ist im Gravitationsfeld zu beachten, dass das Gleichgewicht bei im Allgemeinen verschiedenen Temperaturen zwischen den Systemen A, B und C liegt, denn die Photonen der Temperaturstrahlung (Schwarzkörperstrahlung) erfahren im Gravitationsfeld aufgrund des Äquivalenzprinzips eine Rot-/Blau-Verschiebung; durch die Zeitdilatation werden sie in unterschiedlichen Höhen mit verschiedenen Raten emittiert. Zudem sind deren Flugbahnen gekrümmt, so dass nicht alle von unten startenden Photonen auch oben ankommen können. All diese Effekte bewirken eine mit der Höhe abnehmende Temperatur. Auf der Erde beträgt dieser Effekt aber nur 1,6e-14K/m und ist daher unmessbar klein. Bei einem Neutronenstern ist er aber nicht vernachlässigbar. Wird anstatt der Temperatur die Entropie nicht nur für alle thermodynamischen Systeme, sondern als primärer Begriff im phänomenologischen Sinne eingeführt, so erübrigt sich der nullte Hauptsatz. Erster HauptsatzBilanz für das geschlossene SystemDer erste Hauptsatz der Thermodynamik ist aus dem Satz der Energieerhaltung abgeleitet: jedes System besitzt eine innere Energie U (=extensive Zustandsgröße). Diese kann sich nur durch den Transport von Energie in Form von Arbeit W und/oder Wärme Q über die Grenze des Systems ändern, das heißt:
Die Gleichung gilt für das ruhende System. Beim bewegten System kommen die äußeren Energien Ea (potentielle und kinetische Energie) hinzu: Die Energie eines abgeschlossenen Systems bleibt unverändert. Verschiedene Energieformen können sich demnach ineinander umwandeln, aber Energie kann weder aus dem Nichts erzeugt noch kann sie vernichtet werden. Deshalb ist ein Perpetuum Mobile erster Art unmöglich (kein System verrichtet Arbeit ohne Zufuhr einer anderen Energieform und/oder ohne Verringerung seiner inneren Energie). Eine Einschränkung der Umwandelbarkeit von Wärme in Arbeit ergibt sich erst aus dem zweiten Hauptsatz der Thermodynamik. Siehe auch Hauptartikel Energiegleichung Energiebilanz für ein beliebiges offenes SystemAuf das offene System angewendet, wird der erste Hauptsatz mathematisch anders formuliert. Beim offenen System fließen über die bestimmte Systemgrenze zusätzlich zur mechanischen Arbeit an der verschiebbaren Systemgrenze (Volumenänderungsarbeit z.B. am Kolben in einem Zylinder) die Verschiebearbeiten der Massenströme am Ein- und Austritt. Sie sind das Produkt aus Druck und Volumen. Statt mit der inneren Energie wird beim offenen System deshalb mit den Enthalpien bilanziert, die diesen Term enthalten. Es ist:
Die Bilanz für ein instationäres System, bei dem sowohl Masseinhalt als auch Energieinhalt sich zeitlich ändern, lautet: Dabei sind :
Sonderfälle und Vereinfachungen:
Dabei ist P die Wellenleistung der Maschine. Da vom System abgegebene Energien in der Thermodynamik negativ definiert sind, wird die Leistung einer Turbine aus dieser Gleichung negativ. In der Praxis wird das Vorzeichen deshalb gewechselt. In vereinfachten Berechnungen vernachlässigt man auch die äußeren Energien. Dann lässt sich bei bekannten Zuständen am Eintritt und Austritt die spezifische Leistung direkt als Ordinatendifferenz aus dem h-s-Diagramm ablesen. Energiebilanz für KreisprozesseDa nach dem Durchlaufen eines Kreisprozesses das Arbeitsmedium zum Ausgangszustand zurückkehrt, vereinfacht sich die Bilanz, es entfallen die Änderungen der Zustandsgrößen und es verbleiben die Prozessgrößen Wärme und Arbeit. Wie noch im Zusammenhang mit dem 2. Hauptsatz erläutert wird, kann nicht nur Wärme zugeführt werden, die komplett in Arbeit umgewandelt wird, sondern es muss auch Wärme abgeführt werden. Die einfache Bilanzgleichung lautet: Dabei summiert das Kreisintegral alle Wärmeströme auf. Sie sind positiv, wenn sie in das System eintreten und negativ, wenn sie es verlassen. WKr ist die gesamte Arbeit des Zyklus. Sie ist negativ, wenn sie abgegeben wird. Die Beziehung wird auch oft mit den Wärmebeträgen geschrieben:
wobei die Wärmeabfuhr deutlicher erkennbar wird. Schließlich sollte auch der thermische Wirkungsgrad einer Kraftmaschine noch genannt werden, der den Nutzen (die Kreisprozessarbeit) ins Verhältnis zum Aufwand setzt (die zugeführte Wärme, die meist in Form von Brennstoff bezahlt werden muss). Die abgeführte Wärme wird in der Regel von der Umgebung aufgenommen. Zweiter HauptsatzDer zweite Hauptsatz ermöglicht die Einführung der thermodynamischen Entropie als Zustandsgröße zur numerischen und anschaulichen Beschreibung von Prozessen (vergl. T-s-Diagramm) und auch die Definition der thermodynamischen Temperatur. Er schränkt die Aussage des ersten Hauptsatzes über die Gleichwertigkeit von Wärme und Arbeit ein und ist damit eines der Fundamente der Thermodynamik, wird aber im Rahmen dieser Theorie nicht begründet. Erst im Rahmen der Statistischen Mechanik wird er mit den übrigen Theorien der Physik verknüpft: Je nach philosophischem Standpunkt bekommt er dort eine wahrscheinlichkeitstheoretische Begründung oder wenigstens eine stochastische Formulierung. Die verschiedenen AussagenDer Zweite Hauptsatz der Thermodynamik in der Formulierung von Clausius lautet: Es gibt keine Zustandsänderung, deren einziges Ergebnis die Übertragung von Wärme von einem Körper niederer auf einen Körper höherer Temperatur ist Einfacher ausgedrückt: Wärme kann nicht von selbst von einem Körper niedriger Temperatur auf einen Körper höherer Temperatur übergehen. Diese Aussage scheint zunächst überflüssig zu sein, denn sie entspricht der alltäglichen Erfahrung, wie die über die Anziehungskraft der Erde. Dennoch ist sie äquivalent zu allen weiteren, weniger „selbstverständlichen" Aussagen, denn alle Widersprüche zu den anderen Aussagen lassen sich auf einen Widerspruch zu dieser zurückführen. Der Zweite Hauptsatz der Thermodynamik in der Formulierung von Kelvin und Planck lautet: Es gibt keine Zustandsänderung, deren einzige Ergebnisse das Abkühlen eines Körpers und das Heben eines Gewichtes sind. Dem ersten Hauptsatz würde die Annahme nicht widersprechen, dass es möglich ist, einer – wie immer auch gearteten – Kraftmaschine einen stetigen Wärmestrom zuzuführen, den diese vollständig als mechanische oder elektrische Leistung abgibt. Eine solche Maschine wird als Perpetuum mobile zweiter Art bezeichnet. Eine entsprechende Formulierung des zweiten Hauptsatzes lautet: Ein Perpetuum mobile zweiter Art ist unmöglich Nimmt man an, es gäbe diese von einer Wärmesenke zur Wärmeabfuhr unabhängige Kraftmaschine, so könnte damit der Umgebung, z. B. dem Meerwasser, Wärme entzogen und in mechanische Arbeit umgewandelt werden. Man könnte damit auch gemäß dem Bild rechts die Wärme aus einem Reservoir oder Behälter entziehen und mit der umgewandelten Energie eine Wärmepumpe antreiben, die mit einem reversiblen Carnot-Prozess Wärme aus einem anderen Behälter mit niedrigerer Temperatur in den ersteren mit höherer Temperatur fördert. Die in den wärmeren Behälter eingespeiste Wärmemenge wäre dann größer als die von der Kraftmaschine aufgenommene, weil die abgegebene der Wärmepumpe aus der Summe von aufgenommener Wärme und Antriebsarbeit besteht. Denkt man sich die Systemgrenze um beide Maschinen einschließlich der beiden Wärmebehälter gezogen, so wäre innerhalb dieses abgeschlossenen Systems – also ohne Energiezufuhr von außen - letztendlich Wärme von einem kälteren zu einem wärmeren Körper geflossen. Dies ist der Widerspruch zur ersten Aussage. Prinzipiell derselbe Widerspruch ergibt sich aber auch mit der Annahme, man könnte eine Kraftmaschine bauen, die einen größeren Wirkungsgrad aufweist als eine mit einem Carnot-Prozess arbeitende Maschine. Auch diese Maschine würde dem wärmeren Behälter weniger Wärme entnehmen als die von ihr angetriebene Carnot-Wärmepumpe dort einspeist. Die entsprechende Aussageform des zweiten Hauptsatzes lautet: Es gibt keine Wärmekraftmaschine, die bei gegebenen mittleren Temperaturen der Wärmezufuhr und Wärmeabfuhr einen höheren Wirkungsgrad hat als der aus diesen Temperaturen gebildete Carnot-Wirkungsgrad. Die Nennung der mittleren Temperaturen ist deshalb von Bedeutung, weil in der Regel durch Wärmezufuhr oder Wärmeentnahme ein Wärmereservoir seine Temperatur ändert. Unmittelbar in diesem Zusammenhang lässt sich weiter formulieren: Alle reversiblen Wärme-Kraft-Prozesse mit gleichen mittleren Temperaturen der Wärmezufuhr und Wärmeabfuhr haben denselben Wirkungsgrad wie der entsprechende Carnot-Prozess. und: Alle irreversiblen Wärme-Kraft-Prozesse haben einen geringeren Wirkungsgrad. Mit den in der modernen Thermodynamik festgelegten Begriffsdefinitionen (Wärme, Arbeit, Innere Energie, Zustandsgröße, Prozessgröße, adiabat…) und mit der systematischen Einteilung der Systeme kann über die von Clausius eingeführte Zustandsgröße Entropie eine für alle geschlossenen Systeme und Prozesse in offenen Systemen allgemein gültige Aussage des zweiten Hauptsatzes in mathematischer Form gegeben werden (Bei offenen Systemen bezieht sich die Bilanz auf ein Fluidteilchen, das sich durch das System hindurch bewegt und als geschlossenes bewegtes System betrachtet werden kann ( siehe oben ) ).
Dabei ist δWdiss die innerhalb des Systems dissipierte Arbeit (Arbeit, die nicht nach außen gelangt, sondern infolge von Reibungs-, Drosselungs- oder Stoßvorgängen die innere Energie erhöht). Sie ist immer positiv. Man bezeichnet den entsprechenden Term in der Gleichung als "produzierte Entropie" - im Gegensatz zum ersten Term, der "transportierte Entropie" genannt wird und auch negativ sein kann. Für das adiabate System mit δQ = 0 ergibt sich daraus: In einem geschlossenen adiabaten System kann die Entropie nicht abnehmen, sie nimmt in der Regel zu. Nur bei reversiblen Prozessen bleibt sie konstant.
Alle spontan ablaufenden Prozesse sind irreversibel. Dort findet immer eine Entropiezunahme statt. Beispiele sind die Vermischung von zwei unterschiedlichen Gasen und der Wärmefluss von einem heißen zu einem kalten Körper ohne Gewinnung von Arbeit. Die Wiederherstellung des (oft »geordneter« genannten) Anfangszustandes erfordert dann den Einsatz von Energie oder Information (siehe maxwellscher Dämon). Reversible Prozesse sind nicht mit einer Erhöhung der Gesamtentropie verbunden und laufen daher auch nicht spontan ab. Durch die theoretische Beschreibung spontan ablaufender Prozesse zeichnet der zweite Hauptsatz der Thermodynamik eine Richtung der Zeit aus, die mit unserer intuitiven Erfahrungswelt übereinstimmt (vergl. das Beispiel weiter unten). Mit den beschriebenen Zusammenhängen ist auch der folgende Satz eine Aussageform des zweiten Hauptsatzes: Die Thermische Energie eines Systems besteht aus einem Anteil Exergie und einem Anteil Anergie, wobei der exergetische Anteil verschwindet, wenn das System in den Umgebungszustand übergeführt wird Die Exergie ist der umwandelbare Anteil thermischer Energie in andere Energieformen. Wird ein Körper bzw. System mit einem Zustand, der von dem der Umgebung abweicht, reversibel in den Umgebungszustand gebracht, so wird seine Exergie als Arbeit abgegeben. Die Wärme, die ein Körper (z.B. ein heißes Rauchgas im Kessel eines Kraftwerks) abgibt, wenn es sich auf Umgebungstemperatur abkühlt, kann theoretisch über eine Folge von differenziellen Carnot-Prozessen, wie im Bild rechts dargestellt, zur Umwandlung in Arbeit genutzt werden. Der exergetische Anteil ergibt sich durch Aufsummieren der differenziellen (pinkfarbenen) Flächenanteile oberhalb der Umgebungstemperatur TU. Die Wärmesenke für diese Prozesse zur Aufnahme der Anergie (blauer Flächenanteil unterhalb TU) ist die Umgebung. Herrscht bei einem Gas im Ausgangszustand gegenüber dem Umgebungszustand nicht nur eine höhere Temperatur, sondern auch ein höherer Druck, so besteht die gesamte Exergie nicht nur aus dem exergetischen Anteil der Wärme, sondern zusätzlich aus einem Anteil Volumenarbeit. Der thermische Wirkungsgrad der realen Wärmekraftmaschine ist also immer kleiner als 1 und - bedingt durch die von den Maschinen vorgegebene Prozessführung und die unvermeidlichen dissipativen Effekte - auch immer kleiner als der der idealen Wärmekraftmaschine: wobei TU die Umgebungstemperatur ist und Der zweite Hauptsatz hat somit erhebliche technische Auswirkungen. Da viele Maschinen, die mechanische Energie liefern, diese über einen Umweg aus thermischer Energie erzeugen (z. B. Dieselmotor: Chemische Energie Zum Weiterlesen: The Second Law of Thermodynamics (engl.) - eine hervorragende und erfrischend humorvolle Einführung von Prof. emeritus Frank L. Lambert (mit weiterführenden Links auf der letzten Seite) Beispiele1. Beispiel: Ein kräftefreies Gas verteilt sich immer so, dass es das zur Verfügung stehende Volumen vollständig und gleichmäßig ausfüllt. Warum das so ist, versteht man, wenn man den gegenteiligen Fall betrachtet. Man stelle sich eine luftdichte Kiste in der Schwerelosigkeit vor, in der sich ein einziges Partikel bewegt. Die Wahrscheinlichkeit, dieses bei einer Messung in der linken Hälfte der Kiste zu finden, ist dann genau 1/2. Befinden sich dagegen zwei Partikel in der Kiste, dann ist die Wahrscheinlichkeit, beide in der linken Hälfte anzutreffen, nur noch 1/2 • 1/2 = 1/4 und bei N Partikeln dementsprechend 0,5N. Die Anzahl der Atome in einem Gas ist astronomisch hoch. In einem Volumen von einem Kubikmeter bei normalem Druck liegt sie in der Größenordnung von rund 3•1025 Teilchen. Die daraus resultierende Wahrscheinlichkeit, dass sich das Gas in der Kiste spontan in einer Hälfte konzentriert, ist so gering, dass ein solches Ereignis vermutlich niemals eintreten wird. Wie aus den zeitlich umkehrbaren mikroskopischen Gleichungen der klassischen Mechanik (ohne Reibung) die symmetriebrechende makroskopische Gleichung folgt, wird in der statistischen Mechanik geklärt. Zudem erhält die Entropie dort eine anschauliche Bedeutung: sie ist ein Maß der Unordnung eines Systems bzw. der im System enthaltenen Informationen. Allerdings verliert der zweite Hauptsatz in der statistischen Mechanik seinen Status als "streng gültiges" Gesetz, sondern wird dort als Gesetz betrachtet, bei dem Ausnahmen auf makroskopischen Ebenen zwar prinzipiell möglich aber gleichzeitig so unwahrscheinlich sind, dass sie praktisch nicht vorkommen. Auf mikroskopischer Ebene betrachtet führen z. B. kleine statistische Fluktuationen um den Gleichgewichtszustand auch bei abgeschlossenen Systemen dazu, dass die Entropie ebenfalls etwas um den Maximalwert fluktuiert und dabei auch abnehmen kann. 2. Beispiel: Folgendes Beispiel soll die Bedeutung des Begriffs „Zustand“ in der Thermodynamik hervorheben und den Unterschied von Zustandsgrößen und Nicht-Zustandsgrößen illustrieren. Wir betrachten dazu einen mittels eines beweglichen Kolbens abgeschlossenen Zylinder, der mit N0 Molen eines idealen Gases gefüllt ist. Der Zylinder befindet sich in Wärmekontakt mit einem Wärmebad der Temperatur T0. Zunächst befindet sich das System im Zustand 1, charakterisiert durch (T0,V1,N0); dabei ist V1 das Volumen des Gases. Ein Prozess soll das System in den Zustand 2 gegeben durch (T0,V2,N0) mit V2 > V1 bringen. Temperatur und Stoffmenge bleiben also konstant und das Volumen vergrößert sich. Wir diskutieren zwei verschiedene isotherme Prozesse, die das leisten: (1) eine instantane Expansion (Joule-Thomson-Expansion) und (2) eine quasistatische Expansion. Bei Prozess (1) wird der Kolben „unendlich“ schnell herausgezogen (man kann den Prozess auch folgendermaßen realisieren: ein Gefäß mit einem Volumen V2 ist durch eine herausnehmbare Wand in zwei Teilbereiche geteilt, wobei einer das Volumen V1 besitzt und mit dem idealen Gas gefüllt ist. Der andere Teilbereich ist evakuiert. Der Prozess ist dann durch das Herausziehen der Zwischenwand gegeben). Dabei leistet das Gas keine Arbeit, es ist also δW = 0. Experimentell zeigt sich, dass sich die Energie des Gases nicht ändert (der mittlere Geschwindigkeitsbetrag der Gasteilchen bleibt gleich), daher ist auch die Wärme („in Form von Wärme zugeführte Energie“) gleich Null: δQ = 0. Zusammengefasst: Bei Prozess (1) ist die Energie von Anfangs- und Endzustand gleich. Die Energieformen Arbeit und Wärme verschwinden. Bei Prozess (2) wird der Kolben sehr langsam herausgezogen und dadurch das Volumen vergrößert. Das Gas leistet Arbeit, es ist δW < 0. Da die Energie von Anfangs- und Endzustand aber dieselbe ist (die Energie ist eine Zustandsgröße und hängt nicht von der Prozessführung ab!), muss nach dem ersten Hauptsatz bei dem Prozess Energie in Form von Wärme zugeführt werden: δQ = − δW > 0. Zusammengefasst: Bei Prozess (2) ist die Energie von Anfangs- und Endzustand (ebenfalls) gleich. Das System leistet Arbeit („verliert Energie in Form von Arbeit“) und erhält vom Wärmebad Energie in Form von Wärme. Insgesamt sieht man also, dass die Energieformen Wärme und Arbeit von der konkreten Realisierung des Prozesses abhängen. In der Thermodynamik benutzt man die Bezeichnung d für Differentiale von Zustandsgrößen und δ für infinitesimal kleine Änderungen von Nicht-Zustandsgrößen. Ein System besitzt in einem Zustand eine bestimmte Energie, Entropie, Volumen, etc. aber keine Wärme oder Arbeit! Noch eine Anmerkung: Bei Prozess (1) verlässt das System den thermodynamischen Zustandsraum. Die Zustände, die das System zwischen Anfangs- und Endzustand einnimmt, sind keine thermodynamischen Gleichgewichtszustände. Daher sind die Differentiale im 1. Hauptsatz nicht definiert. Dieser gilt jedoch auch für endliche Differenzen. Die obige Betrachtung ist auch für einen nicht-quasistatischen Prozess korrekt. Zusammenfassung der Aussagen des zweiten Hauptsatzes
GültigkeitDer Zweite Hauptsatz der Thermodynamik stellt eine Erfahrungstatsache dar. Es ist bis heute nicht gelungen, dieses fundamentale Gesetz der klassischen Physik in seiner allgemeinen Gültigkeit für beliebige makroskopische Systeme ausgehend von der Grundgleichung der Quantentheorie, der Vielteilchen-Schrödingergleichung, zu beweisen. Dritter HauptsatzDieser Hauptsatz wurde von Walther Nernst im Jahr 1906 vorgeschlagen und ist auch als Nernst-Theorem bekannt. Er ist quantentheoretischer Natur und verbietet es, ein System bis zum absoluten Nullpunkt abkühlen zu können. Bei der Annäherung der Temperatur an den absoluten Nullpunkt (T = 0) wird die Entropie S unabhängig von thermodynamischen Parametern. Damit geht S gegen einen festen Grenzwert S0: Die konstante Entropie bei T = 0 lässt sich als Für alle physikalisch-chemischen Reaktionen, bei denen die teilnehmenden Stoffe am absoluten Nullpunkt als ideale kristalline Festkörper vorliegen, gilt: Es gibt nur eine Realisierungsmöglichkeit für ideale Festkörper am absoluten Nullpunkt, Ω0 = 1. Thermodynamik irreversibler ProzesseNeben der klassischen Gleichgewichtsthermodynamik wurde im 20. Jahrhundert die Nichtgleichgewichtsthermodynamik oder auch Thermodynamik irreversibler Prozesse entwickelt. Die klassische Thermodynamik macht über Nichtgleichgewichtsprozesse nur die qualitative Aussage, dass diese nicht umkehrbar sind, beschränkt sich aber in ihren quantitativen Aussagen auf Systeme, die stets global im Gleichgewicht sind, bzw. nur inkrementell davon abweichen. Demgegenüber behandelt die Nichtgleichgewichtsthermodynamik Systeme, die sich nicht in einem globalen thermodynamischen Gleichgewicht befinden, sondern davon abweichen. Oft wird jedoch noch lokales thermodynamisches Gleichgewicht angenommen. Ein wichtiges Ergebnis der Nichtgleichgewichtsthermodynamik ist das Prinzip der minimalen Entropieproduktion für offene Systeme, welche nur wenig vom thermodynamischen Gleichgewicht abweichen. Dies ist der Bereich der so genannten linearen Nichtgleichgewichtsthermodynamik. Weicht ein offenes System stark vom Gleichgewicht ab, kommt die nichtlineare Nichtgleichgewichtsthermodynamik zum Zug. Wichtiges Ergebnis in diesem Bereich ist das Stabilititätskriterium von Ilya Prigogine und Paul Glansdorff, das angibt, unter welchen Bedingungen der Zustand mit der minimalen Entropieproduktion instabil wird und ein System bei gleichzeitigem Entropieexport eine höher geordnete Struktur annehmen kann. In diesem Bereich können also spontan so genannte dissipative Strukturen entstehen, die experimentell bestätigt wurden (beispielsweise Bénard-Zellen). Da in diesem nichtlinearen Bereich auch biologische Prozesse anzusiedeln sind, ist dieses Resultat besonders auch in Hinsicht auf die Entwicklung des Lebens von großer Bedeutung. Vertreter
Siehe auch
VideoAlpha Centauri Was ist Entropie? LiteraturAllgemein
Chemische Thermodynamik
Statistische ThermodynamikTechnische Thermodynamik
Bemerkungen zu einigen dieser Bücher:hier Thermodynamik in der Biologie
Kategorien: Thermodynamik | Physikalische Chemie |
|
| Dieser Artikel basiert auf dem Artikel Thermodynamik aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





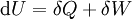 Dabei ist
Dabei ist 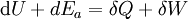
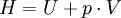 bzw.
bzw. 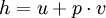
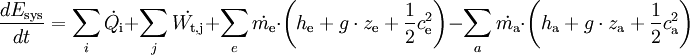
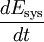 ...........die zeitliche Änderung der inneren Energie des Systems.
...........die zeitliche Änderung der inneren Energie des Systems.
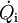 ..................der Wärmestrom über die Systemgrenze.
..................der Wärmestrom über die Systemgrenze.
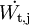 ...............der Arbeitsstrom (
...............der Arbeitsstrom (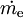 ................der Massenstrom in das System.
................der Massenstrom in das System.
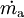 ................der Massenstrom aus dem System
................der Massenstrom aus dem System
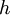 ...................die
...................die 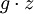 .............die spezifische potentielle Energie (mit
.............die spezifische potentielle Energie (mit 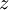 = Höhe über dem Bezugsniveau und
= Höhe über dem Bezugsniveau und 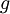 = Erdbeschleunigung)
= Erdbeschleunigung)
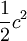 ...............die spezifische kinetische Energie (mit
...............die spezifische kinetische Energie (mit 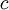 = Geschwindigkeit).
= Geschwindigkeit).
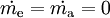 (siehe oben)
(siehe oben)
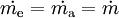 und
und 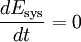
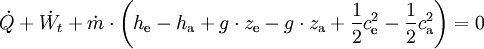 oder:
oder:
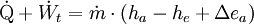
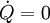
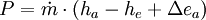
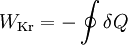
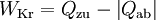 ,
,
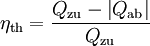
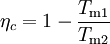
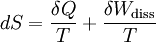
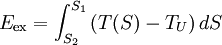
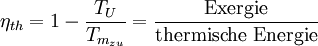
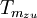 die mittlere Temperatur der Wärmezufuhr. Sie ergibt sich, wenn die gelbe Fläche der Exergie durch ein flächengleiches Rechteck oberhalb der Linie der Umgebungstemperatur ersetzt wird.
die mittlere Temperatur der Wärmezufuhr. Sie ergibt sich, wenn die gelbe Fläche der Exergie durch ein flächengleiches Rechteck oberhalb der Linie der Umgebungstemperatur ersetzt wird.
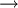 thermische Energie
thermische Energie 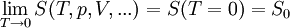
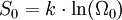 darstellen, wobei
darstellen, wobei 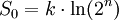 ergeben.
ergeben.