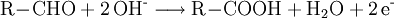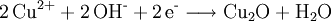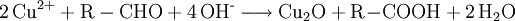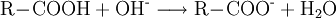Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Fehling-ProbeDie Fehling-Probe dient zum Nachweis einer Aldehydgruppe (-CHO) in Aldehyden und reduzierenden Zuckern. Produkt-HighlightZur Durchführung der Fehling-Probe verwendet man zwei Lösungen als Nachweisreagenzien, die nach Hermann Fehling als "Fehling I" und "Fehling II" bezeichnet werden. Die hellblaue Fehlingsche Lösung I ist eine verdünnte Kupfer(II)-sulfat-Lösung (70 g Kupfersulfat-pentahydrat (CuSO4 · 5 H2O) auf 1 L Wasser auffüllen). Die farblose Fehlingsche Lösung II ist eine alkalische Kaliumnatriumtartrat-Lösung (100 g Natriumhydroxid (NaOH) in ca. 500 mL Wasser (H2O) lösen und darin 340 g Kaliumnatriumtartrat-tetrahydrat (KNaC4H4O6 · 4 H2O) lösen und auf 1 L auffüllen). Der Zusatz von 150 ml reinstem Glycerin vor dem Auffüllen mit Wasser verlängert die Haltbarkeit einer selbst angesetzten Lösung. Nach Zusammenführen gleicher Volumina beider Fehling-Lösungen besitzt das Fehling-Reagenz aufgrund der Komplexbildung der Cu(II)-Ionen mit den Tartrat-Ionen eine charakteristische, dunkelblaue Farbe. Nach Zugabe der Testsubstanz erfolgt in der Wärme die Reduktion der Kupfer(II)-Ionen erst zu gelbem Kupfer(I)-hydroxid (CuOH) und dann eine Umlagerung zu Kupfer(I)-oxid (Cu2O). Aldehyde werden nach Zugabe von Fehling-Reagenz zu Carbonsäuren oxidiert, während das Kupfersulfat (CuSO4) zu Kupfer(I)-oxid (Cu2O) reduziert wird und als rotbrauner Niederschlag ausfällt. Bei längerem Erhitzen oder bei einfacheren Aldehyden wie Formaldehyd oder Acetaldehyd kann auch elementares Kupfer entstehen. Die Fehlingprobe - eine RedoxreaktionDa die Oxidation der Probesubstanz durch Reduktion der Kupfer(II)-Ionen erfolgt, kann die Gesamtreaktion wie bei allen Redoxreaktionen in eine Oxidations- und Reduktionsreaktion zerlegt werden. Dabei wird im nachfolgenden Beispiel zur Vereinfachung nicht berücksichtigt, dass die Kupferionen eigentlich in einem Komplex mit Tartrat-Ionen (Kupfertartrat) vorliegen:
Oxidation: Reduktion: Redoxreaktion:
|
| Dieser Artikel basiert auf dem Artikel Fehling-Probe aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |