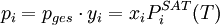Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Raoultsches GesetzAls Raoultsches Gesetz werden verschiedene auf François Marie Raoult zurückgehende Gesetzmäßigkeiten der Chemie und der Thermodynamik bezeichnet. Produkt-Highlight
Raoultsches Gesetz der DampfdruckerniedrigungIm Stoffgemisch einer Lösung tritt der Lösungseffekt auf. Die relative Erniedrigung des Sättigungsdampfdrucks über der Lösung mit ebener Oberfläche (Krümmungseffekt) ist dabei gleich dem Produkt aus dem Dampfdruck des Lösungsmittels mal seinem Stoffmengenanteil. Die Dampfdruckerniedrigung ist somit kolligativ, also nur von der Teilchenzahl des gelösten Stoffes und nicht von dessen chemischen Eigenschaften abhängig. Hierbei stehen die einzelnen Formelzeichen für die folgenden Größen:
Raoultsches Gesetz der SiedepunkterhöhungDer obige Lösungseffekt ist für die Siedepunkterhöhung verantwortlich. Dabei ergibt sich mit der Clausius-Clapeyron-Gleichung folgender Zusammenhang: Dabei ist R die allgemeine Gaskonstante, T die Temperatur und Qv die molare Verdampfungswärme.
Ersetzt man Qv mit der molaren Schmelzwärme Qs so erhält man die Gefrierpunkterniedrigung.
Gesetz zur Berechnung des Gas-Flüssig-GleichgewichtsIm Bereich der Mischphasenthermodynamik wird das Raoultsche Gesetz zur Berechnung des Gas-Flüssigkeits-Gleichgewichts (engl.:Vapour-Liquid-Equilibrium)
verwendet. Kategorien: Destillation | Thermodynamik |
|
| Dieser Artikel basiert auf dem Artikel Raoultsches_Gesetz aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |




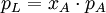
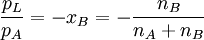
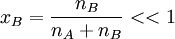 , für verdünnte Lösungen
, für verdünnte Lösungen
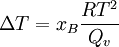
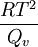 ist eine Proportionalitätskonstante (
ist eine Proportionalitätskonstante (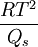 nennt man dann
nennt man dann 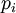 einer reinen Komponente (selbstverständlich in der Gasphase) und deren
einer reinen Komponente (selbstverständlich in der Gasphase) und deren 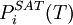 die
die 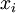 in der Flüssigphase bestimmen.
in der Flüssigphase bestimmen.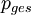 herrscht :
herrscht :