Ein Molekül wie eine Mini-Batterie
Chemiker entschlüsseln komplexe elektronische Struktur einer dreikernigen metallorganischen Verbindung mit der Fähigkeit, mehrere Elektronen aufzunehmen und abzugeben
Anzeigen
Wie funktionieren und wirken molekulare Katalysatoren – also Moleküle, die ähnlich wie Enzyme bestimmte chemische Reaktionen ermöglichen oder beschleunigen können? Diesem Verständnis sind Oldenburger Chemiker anhand eines Modell-Moleküls nähergekommen, das wie eine molekulare Nanobatterie funktioniert. Es besteht aus mehreren Titan-Metallzentren, die über eine nur atomdicke Schicht aus Kohlenstoff und Stickstoff miteinander verbunden sind. Die Erkenntnisse, für die die Ergebnisse aus gleich drei jeweils mehrjährigen Promotionsprojekten zusammenflossen, hat das siebenköpfige Autorenteam kürzlich in „ChemPhysChem“ veröffentlicht.
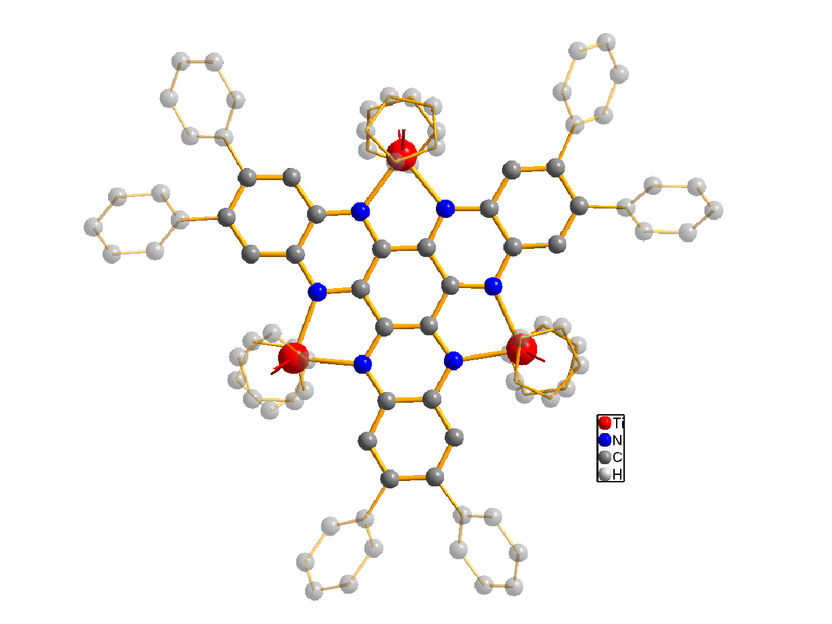
Die Struktur des untersuchten Moleküls (Titan in rot dargestellt, Stickstoff in blau, Kohlenstoff in grau). Der Grundkörper des Moleküls ist hervorgehoben, die Wasserstoffatome zur Vereinfachung hingegen ausgeblendet.
Rüdiger Beckhaus / Universität Oldenburg

Der Hochleistungs-Rechencluster der Universität Oldenburg trug mit quantenchemischen Rechnungen dazu bei, das Verhalten des Modell-Moleküls zu entschlüsseln.
Daniel Schmidt / Universität Oldenburg

Um die Funktionsweise des Moleküls zu verstehen, kombinierten die Wissenschaftler um die Erstautoren Dr. Aleksandra Markovic und Luca Gerhards sowie den korrespondierenden Autor Prof. Dr. Gunther Wittstock elektrochemische und spektroskopische Experimente mit dem Einsatz des Hochleistungs-Rechenclusters der Universität. Die Fachzeitschrift für physikalische Chemie und chemische Physik würdigte die Oldenburger Grundlagenforschung als Titelthema. Für Wittstock ist die Publikation eine „Erfolgsgeschichte“ der Graduiertenkollegs, in denen die Promotionsprojekte angesiedelt waren, sowie des Rechenclusters. „Ohne die Infrastruktur an hochleistungsfähigen Rechnern hätten wir die umfangreichen Rechnungen nicht ausführen und somit das Verhalten des Moleküls nicht entschlüsseln können“, so Wittstock. „Das unterstreicht die Bedeutung, die solche Rechenzentren mittlerweile für die Forschung besitzen.“
Konkret untersuchte das Autorenteam eine Molekülstruktur, deren Prototyp in einer überraschenden Reaktion bereits 2006 erstmals in den Laboren des Oldenburger Instituts für Chemie entstand, die aber bislang in vielerlei Hinsicht noch Rätsel aufgab. Es handelt sich um ein sehr komplexes Molekül, in dem der aus Kohlenstoff und Stickstoff bestehende sogenannte Brückenligand drei Titan-Metallzentren verbindet (aus dem Chemieunterricht in der Schule manchem womöglich eher als Titan-Ionen geläufig).
Bei einer solchen Verbindung steht zu erwarten, dass sie mehrere Elektronen aufnehmen und abgeben kann, unter anderem indem die Metallzentren untereinander Elektronen austauschen – eine Aktivität, deren Verstehen nicht nur in der Grundlagenforschung besonderes Interesse erregt: Denn Reaktionen zu ermöglichen oder beschleunigen, bei denen mehr als ein Elektron übertragen wird, stellt in technischen Systemen eine große, bislang nicht gut gelöste Herausforderung dar. „Darauf konzentrieren sich gegenwärtig viele Anstrengungen“, sagt Wittstock. Ein Beispiel sei die Technologie der Brennstoffzelle, wo für einen Elektronenfluss von Wasserstoff auf Sauerstoff gleichzeitig vier Elektronen auf ein Sauerstoffmolekül übertragen werden müssen. „Solche Mehrelektronen-Reaktionen bergen auch in der chemischen Produktion große Potenziale, um Material oder Energie einsparen zu können.“
Die Modellverbindung aus Brückenligand und Titanzentren sollte helfen, um im Detail verstehen zu können, wie Verbindungen mit mehreren Metallzentren Elektronen aufnehmen und abgeben können. Dies wird durch Anregung mit Licht entschlüsselt, auf das das Molekül je nach auf- oder abgegeben Elektronen anders reagiert. Leider war das Molekül in vielen Lösungsmitteln nur schlecht löslich und daher kaum zu untersuchen. Dr. Pia Sander, Ko-Autorin des Aufsatzes, fügte durch chemische Synthese propellerartig geformte Molekülteile an, um die Löslichkeit zu verbessern. So schaffte sie die Voraussetzung für die Experimente von Markovic, die wiederum herausfand, dass die Modellverbindung insgesamt drei Elektronen aufnehmen oder aber sechs Elektronen abgeben kann – eine ungewöhnlich hohe Kapazität für ein einzelnes Molekül. Bei jeder dieser Reaktionen ändert sich nicht nur die sichtbare Farbe des Moleküls, sondern auch der fürs menschliche Auge teils unsichtbare Spektralbereich. Der genaue Wechsel zwischen den unterschiedlichen Zuständen ließ sich anhand der Spektren allerdings zunächst nicht erklären.
An dieser Stelle kamen Gerhards sowie der Rechencluster der Universität ins Spiel. Während gängige Erklärungen davon ausgehen, dass sich bei jedem durch Licht angeregten Übergang nur die Energie eines einzigen Elektrons ändert, vermied Ko-Autor Gerhards derartige vereinfachende Vorannahmen bei seinen quantenchemischen Gleichungen. Dadurch wurden die Rechnungen noch komplexer und beschäftigten den Hochleistungs-Rechencluster monatelang. Am Ende stand das für alle beteiligten Wissenschaftler überraschende Ergebnis, dass im untersuchten Modell-Molekül gleich mehrere Elektronen zugleich ihre Energieniveaus ändern, wenn Licht auf die Substanz trifft.
Zudem wird diese Ladung nicht – wie erwartet – auf dem Titan gespeichert, sondern vorwiegend auf dem Brückenliganden, dem „Verbindungsstück“ dazwischen. Die Metallzentren bilden dabei sozusagen einen positiv aufgeladenen Rahmen für den Elektronenspeicher als „Minibatterie“, wie Wittstock erläutert. Das Modell-Molekül – und damit eine ganze Klasse ähnlicher Verbindungen – habe sich als „Mini-Ausschnitt aus einem Energiespeichermaterial“ erwiesen. Zwar lässt sich dessen Potenzial noch nicht abschätzen, aber Wittstock zufolge könnten solche „Rahmen“ perspektivisch ein neues Designelement komplexer molekularer Katalysatoren für Mehrelektronen-Reaktionen quasi mit eingebautem Elektronenspeicher werden.
Originalveröffentlichung
Aleksandra Markovic, Luca Gerhards, Pia Sander, Carsten Dosche, Thorsten Klüner, Rüdiger Beckhaus, Gunther Wittstock; "Electronic Transitions in Different Redox States of Trinuclear 5,6,11,12,17,18‐Hexaazatrinaphthylene‐Bridged Titanium Complexes: Spectroelectrochemistry and Quantum Chemistry"; ChemPhysChem; 2020, 21, 2506-2514
































































