Synthese eines seltenen Metallkomplexes von Distickstoffoxid eröffnet neue Perspektiven für den Abbau eines potenten Treibhausgases
Die Wahl des richtigen Partners
Anzeigen
Lachgas (N2O) ist wie sein chemischer Verwandter Kohlendioxid (CO2) ein wichtiges Treibhausgas und die dominierende ozonabbauende Substanz, die im 21. Jahrhundert emittiert wird. Daher werden Strategien zur Begrenzung seiner Emissionen und seiner katalytischen Zersetzung mit Metallen entwickelt. Eine aktuelle Studie zeigt, dass Distickstoffoxid ähnlich wie Kohlendioxid an Metalle binden kann, was hilft, neue Komplexe mit noch stärkerer Bindung zu entwerfen. Dies könnte die Verwendung von Lachgas in der synthetischen Chemie ermöglichen oder helfen, es zu für die Atmosphäre unschädlichen Substanzen abzubauen. Die Ergebnisse wurden am 17. Februar 2021 in der Zeitschrift Angewandte Chemie International Edition als Very Important Paper veröffentlicht.
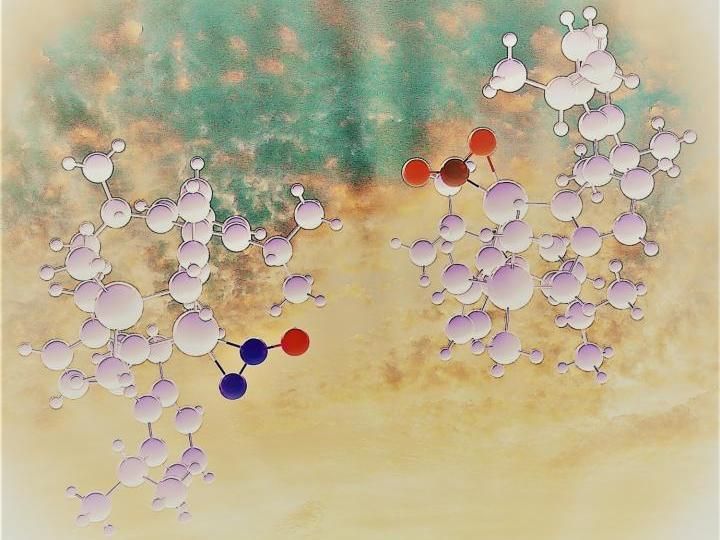
Zwei Erbsen in einer Schote. Analoge Metallkomplexe von Distickstoffoxid und Kohlendioxid helfen, Unterschiede und Gemeinsamkeiten in der Chemie zweier wichtiger Treibhausgase zu erklären.
Monika Stolar and Chris Gendy
Eine umfassende Analyse des globalen N2O-Budgets hat gezeigt, dass seine Emissionen in den letzten vier Jahrzehnten zugenommen haben, wobei landwirtschaftliche Aktivitäten für das Wachstum verantwortlich sind. Obwohl N2O in der Atmosphäre in einer 1000-mal geringeren Konzentration als CO2 vorhanden ist, ist es als Treibhausgas etwa 300-mal potenter.
In der Natur wird N2O durch Enzyme in N2 und H2O umgewandelt. Dieser Prozess kann im Labor mit katalytischen Metallkomplexen nachgeahmt werden. Überraschenderweise sind wohldefinierte Komplexe von N2O mit Übergangsmetallen äußerst selten, obwohl CO2 eine reichhaltige und gut dokumentierte Koordinationschemie aufweist. Das sehr unterschiedliche Verhalten dieser beiden verwandten kleinen Moleküle wurde auf die schlechten Ligandeneigenschaften von N2O im Vergleich zu CO2 zurückgeführt, aber die Ursprünge und Details dieser Begründung sind schwer zu verfolgen.
"Je mehr Informationen wir zu diesem Thema zu finden versuchten, desto näher kamen wir einem Zirkelschluss", sagt Dr. Heikki M. Tuononen von der Universität Jyväskylä, Finnland. "In vielen Fällen wurde irgendeine Eigenschaft von N2O hervorgehoben, aber sie sind fast alle auch für CO2 charakteristisch", fährt er fort.
"Dieses Rätsel war einer der Gründe, warum unsere Forschungsteams während Dr. Tuononens Besuch in Calgary als Killam-Stipendiat beschlossen, ihre Kräfte zu bündeln und analoge Metallkomplexe von N2O und CO2 zu synthetisieren und die Metall-Ligand-Wechselwirkung im Detail zu untersuchen", erzählt Dr. Roland Roesler von der University of Calgary, Kanada.
Ein seltener Metallkomplex von N2O, der sogar bei Raumtemperatur stabil ist
Die Ergebnisse der zweijährigen Untersuchung zeigten, dass entgegen der allgemeinen Ansicht die Metallbindungsfähigkeit von N2O gleich gut oder sogar besser ist als die von CO2.
"Es scheint, dass der oxidierende Charakter von N2O größtenteils, wenn nicht sogar vollständig, für die Seltenheit von Metallkomplexen mit diesem Liganden verantwortlich ist", sagt Dr. Tuononen.
"Nachdem wir den richtigen Metallpartner für N2O gefunden hatten, war die Bindung stark genug, dass ein seltener, seitlich gebundener Komplex sogar bei Raumtemperatur isoliert und charakterisiert werden konnte", fährt Dr. Chris Gendy, ein ehemaliger Doktorand der University of Calgary, der für die synthetischen Arbeiten mitverantwortlich war, fort.
Die Arbeit der beiden Forscherteams zeigt nicht nur, dass N2O eine bessere intrinsische Fähigkeit hat, an Metalle zu binden, als bisher bekannt, sondern ermöglicht auch das rationale Design von N2O-Komplexen, die noch stabiler sind als die bisher charakterisierten. Dies könnte wiederum neue Wege für den Einsatz von N2O in der synthetischen Chemie eröffnen.
"N2O ist in vielerlei Hinsicht ein großartiges Oxidationsmittel. Es ist thermodynamisch stark, relativ billig und liefert N2 als einziges Nebenprodukt", erklärt Dr. Tuononen.
"Es wäre sicherlich großartig, wenn N2O als Oxidationsmittel in metallkatalysierten Reaktionen häufiger eingesetzt werden würde. Gleichzeitig sollten wir die Rolle, die es in der Atmosphäre spielt, nicht vergessen", ergänzt Dr. Roesler.
"Die Natur hat elegante enzymatische Wege gefunden, um N2O in Produkte umzuwandeln, die für die Atmosphäre unschädlich sind. Das Gleiche sollten wir mit unseren vom Menschen verursachten Emissionen anstreben, indem wir neuartige Katalysatoren verwenden", schließen die Forscherteams.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.

Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.
































































