Struktur eines "ölfressenden" Enzyms öffnet die Tür zu biotechnologisch hergestellten Katalysatoren
Details auf atomarer Ebene zeigen, wie das Enzym selektiv Kohlenwasserstoffbindungen aufbricht, was auf biotechnologische Strategien zur Herstellung nützlicher Chemikalien hindeutet
Anzeigen
Wissenschaftler des Brookhaven National Laboratory des US-Energieministeriums haben die erste Struktur eines Enzyms auf atomarer Ebene erstellt, das selektiv Kohlenstoff-Wasserstoff-Bindungen schneidet - der erste und schwierigste Schritt bei der Umwandlung einfacher Kohlenwasserstoffe in nützlichere Chemikalien. Wie in einer in Nature Structural & Molecular Biology veröffentlichten Arbeit beschrieben, zeigt die detaillierte "Blaupause" auf atomarer Ebene Wege auf, das Enzym so zu verändern, dass es die gewünschten Produkte produziert.
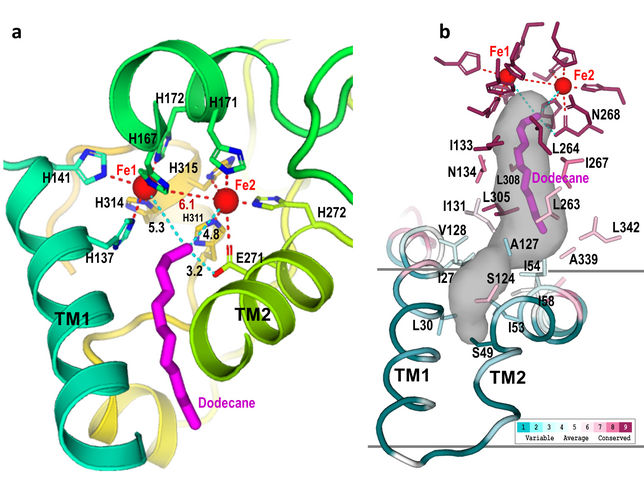
Aktives Zentrum: Diese Nahaufnahmen des AlkB-Aktivzentrums zeigen, wie neun Histidin-Aminosäuren (im linken Bild als "H" bezeichnet) einen Hohlraum bilden (grau schattierter Bereich, rechts). Dieser Hohlraum leitet das Substrat (magenta) in einer einzigen Ausrichtung zum aktiven Zentrum (in der Nähe der beiden Eisenatome), wo nur die terminale Kohlenstoff-Wasserstoff-Bindung gespalten werden kann. Wenn man das Enzym so verändert, dass die Form dieses Hohlraums verändert wird, könnte das Enzym verschiedene C-H-Bindungen angreifen.
Brookhaven National Laboratory
"Wir wollen einen vielfältigen Pool von Biokatalysatoren schaffen, bei denen man gezielt das gewünschte Substrat auswählen kann, um aus den reichlich vorhandenen Kohlenwasserstoffen die gewünschten und einzigartigen Produkte herzustellen", sagte der Co-Leiter der Studie, Qun Liu, ein Strukturbiologe am Brookhaven Lab. "Der Ansatz würde uns eine kontrollierbare Möglichkeit bieten, billige und reichlich vorhandene Alkane - einfache Kohlenstoff-Wasserstoff-Verbindungen, die 20-50 Prozent des Rohöls ausmachen - in wertvollere Bioprodukte oder chemische Vorprodukte, einschließlich Alkohole, Aldehyde, Carboxylate und Epoxide, umzuwandeln.
Die Idee ist besonders attraktiv, weil bei den meisten industriellen katalytischen Prozessen zur Umwandlung von Alkanen unerwünschte Nebenprodukte und wärmefressendes Kohlendioxid (CO2) entstehen. Außerdem enthalten sie kostspielige Materialien und erfordern hohe Temperaturen und hohen Druck. Das biologische Enzym mit dem Namen AlkB arbeitet unter einfacheren Bedingungen und mit sehr hoher Spezifität. Es verwendet kostengünstiges, in der Erde reichlich vorhandenes Eisen, um die Chemie in Gang zu setzen, und erzeugt dabei nur wenige unerwünschte Nebenprodukte.
"Die Natur hat herausgefunden, wie man diese Art von Chemie mit einem preiswerten, reichlich vorhandenen Metall und bei Umgebungstemperatur und -druck durchführen kann", sagte John Shanklin, Vorsitzender des Brookhaven Lab's Biology Department und einer der Hauptautoren der Studie. "Infolgedessen gab es ein großes Interesse an diesem Enzym, aber ein völliges Unverständnis seiner Architektur und seiner Funktionsweise - was notwendig ist, um es für neue Zwecke umzugestalten. Mit dieser Struktur haben wir dieses Hindernis nun überwunden".
Vom ranzigen Öl zum süßen Erfolg
AlkB wurde vor 50 Jahren in einer Maschinenwerkstatt entdeckt, wo Bakterien Kühlöl verdauten und es ranzig riechen ließen. Biochemiker entdeckten das bakterielle Enzym AlkB als den Faktor, der den ungewöhnlichen Appetit der Mikroben ermöglichte. Seitdem sind Wissenschaftler daran interessiert, sich die Fähigkeit von AlkB, Kohlenwasserstoffe zu fressen, zunutze zu machen.
Im Laufe der Jahre zeigten Studien, dass das Enzym teilweise in die Membranen der Bakterien eingebettet ist und mit zwei anderen Proteinen zusammenarbeitet. Shanklin und Liu - und auch andere Wissenschaftler - versuchten, die Struktur des Enzyms mithilfe der Röntgenkristallographie zu entschlüsseln. Bei dieser Methode wird eine kristallisierte Version eines Proteins mit hochintensiven Röntgenstrahlen bestrahlt, um zu ermitteln, wo sich die Atome befinden. Aber Membranproteine wie AlkB sind bekanntermaßen schwer zu kristallisieren - vor allem, wenn sie Teil eines Multiproteinkomplexes sind.
"Wir konnten keine ausreichend hohe Auflösung erzielen", so Liu.
Anfang 2021 eröffnete Brookhaven dann seine neue Kryo-Elektronenmikroskop-Einrichtung (Kryo-EM), das Laboratory for BioMolecular Structure (LBMS). Die Wissenschaftler nutzten ein Kryo-EM, das keine kristallisierte Probe benötigt, um Bilder von einigen Millionen einzelner gefrorener Proteinmoleküle aus vielen verschiedenen Blickwinkeln zu machen. Computergestützte Werkzeuge sortierten dann die Bilder, identifizierten und mittelten die gemeinsamen Merkmale und erstellten schließlich eine hochauflösende, dreidimensionale Karte des Enzymkomplexes. Anhand dieser Karte setzten die Wissenschaftler dann die bekannten atomaren Strukturen der einzelnen Aminosäuren, aus denen der Proteinkomplex besteht, zusammen, um die Details in drei Dimensionen zu vervollständigen.
Die richtigen Bedingungen zu finden, um die Transmembranregion des Enzyms zu stabilisieren und die strukturellen Details beizubehalten, war eine Herausforderung, die ein hohes Maß an Versuch und Irrtum erforderte. Shanklin lobt Jin Chai, einen der Forscher in seinem Labor, "für sein Engagement und seine Entschlossenheit, dieses Rätsel zu lösen."
Struktur enthüllt Funktionsweise des Enzyms
Die detaillierte Struktur zeigt genau, wie AlkB und eines der beiden assoziierten Proteine (AlkG) zusammenarbeiten, um Kohlenstoff-Wasserstoff-Bindungen zu spalten. Tatsächlich enthielt die gelöste Struktur einen unerwarteten Bonus: ein Substrat-Alkanmolekül, das in der aktiven Stelle des Enzyms gefangen war.
"Unsere Struktur zeigt, wie die Aminosäuren, aus denen dieses Enzym besteht, einen Hohlraum bilden, der das Kohlenwasserstoff-Substrat so ausrichtet, dass nur eine bestimmte Kohlenstoff-Wasserstoff-Bindung an das aktive Zentrum herankommt", sagte Liu. "Es zeigt auch, wie Elektronen vom Trägerprotein (AlkG) zum Di-Eisen-Zentrum an der aktiven Stelle des Enzyms wandern, so dass es ein Sauerstoffmolekül aktivieren kann, um diese Bindung anzugreifen".
Shanklin schlägt vor, sich das Enzym als eine Maschine vorzustellen, die Bindungen wie eine Kreissäge durchschneidet: "Wie man das Alkan in Bezug auf das Di-Eisen-Zentrum des Enzyms hält, bestimmt, wie der aktivierte Sauerstoff mit dem Kohlenwasserstoff interagiert. Wenn man das Ende des Alkans gegen den aktivierten Sauerstoff führt, wird es am letzten Kohlenstoff eine chemische Reaktion auslösen.
"Wir wollen die Form der aktiven Stelle verändern, damit das Substrat (oder ein anderes Substrat) sich dem aktivierten Sauerstoff in verschiedenen Winkeln und an verschiedenen Stellen der C-H-Bindung nähern kann, um verschiedene Reaktionen durchzuführen.
In der Natur, so die Wissenschaftler, liefert ein drittes, in dieser Struktur nicht enthaltenes Protein (AlkT) die Elektronen an AlkG, das Trägerprotein. Das Trägerprotein transportiert dann die Elektronen zu den beiden Eisenatomen, die den Sauerstoff an der aktiven Stelle von AlkB aktivieren. Der Ersatz dieses elektronenspendenden Proteins durch eine Elektrode zur Elektronenversorgung wäre einfacher und kostengünstiger als die Verwendung des biologischen Elektronenspenders, schlagen sie vor.
Das DOE hat gerade den Antrag des Teams zur Entwicklung solcher "Transformative Biohybrid-Diiron-Katalysatoren für die C-H-Bindungsfunktionalisierung" finanziert, der zum Teil auf dieser vorläufigen Strukturarbeit beruht.
"Diese Struktur und unser Wissen über die Funktionsweise des AlkG/AlkB-Komplexes versetzen uns in die Lage, dieses Enzym biotechnisch zu verändern, um auszuwählen, welche Kohlenstoff-Wasserstoff-Bindung in einer Vielzahl von Substraten aktiviert wird, und um die Elektronen und den Sauerstoff zu kontrollieren, um seine Selektivität neu zu gestalten", sagte Liu.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.