Von der Mikroskopie zur Nanoskopie
Photoschaltbare Rhodaminamide für die hochaufgelöste optische 3D-Fernfeld-Mikroskopie
Anzeigen
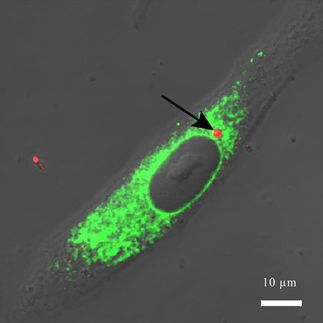
Schichtweise lichtmikroskopische Aufnahmen von Zellen auf der Nanoskala, ohne Dünnschnitte anzufertigen? Ein Team um Stefan Hell und Mariano Bossi vom Max-Planck-Institut für Biophysikalische Chemie in Göttingen macht es jetzt vor mit einer Methode, die sich optische 3D-Fernfeld-Mikroskopie nennt und mit nanoskaliger Auflösung, gutem Signal-Rausch-Verhältnis und relativ kurzen Aufnahmezeiten aufwarten kann. Erfolgsgeheimnis sind spezielle photoschaltbare Fluoreszenzfarbstoffe, wie die Forscher in der Zeitschrift Angewandte Chemie berichten. Diese Rhodaminamide machen die Aufnahme hochaufgelöster 3D-Bilder transparenter, fluoreszenzmarkierter Objekte, etwa Zellen, möglich.
Bis vor nicht allzu langer Zeit galt die Auflösung des Lichtmikroskops als begrenzt durch die Wellenlänge des Lichts. Es gibt zwar nicht-optische Methoden, etwa die Elektronenmikroskopie, aber die Lichtmikroskopie ist noch immer die einzige Methode, um intakte oder sogar lebende Zellen im Innern zu betrachten. Mithilfe von Fluoreszenzfarbstoffen gelingt es, einzelne Zellbestandteile wie Proteine selektiv abzubilden. Heute gilt das Wellenlängen-Dogma als überwunden. Bei dieser "STED-Mikroskopie" (Stimulated Emission Depletion) werden Moleküle von einem "dunklen" (nicht-fluoreszenzten) Grundzustand in einen "hellen" (fluoreszenten) angeregten Energiezustand gebracht, mit einer räumlichen Schärfe weit unterhalb 200 nm.
Nun demonstriert das Göttinger Team die Leistungsfähigkeit eines weiteren Konzepts. Dazu verwendet man Moleküle, die zwischen "fluoreszent" und "nichtfluoreszent" nicht nur überführt, sondern "geschaltet" werden können. Im Gegensatz zum STED-Mikroskop und verwandten Konzepten des Göttinger Teams werden hier nur vereinzelte, isolierte Markermoleküle nach dem Zufallsprinzip gleichzeitig angeschaltet. Ihre Fluoreszenz wird ausgelesen, anschließend gehen sie automatisch wieder aus. So sind gleichzeitig fluoreszierende (angeschaltete) Marker weiter voneinander entfernt als die minimale Distanz, die vom Mikroskop noch aufgelöst werden kann. Das geht nur mit schaltbaren Molekülen, die in ihrem "eingeschalteten" Zustand viele Photonen hintereinander aussenden. Registriert man diese Photonen mit einer Kamera, lässt sich das Zentrum der einzelnen fluoreszierenden Pünktchen ermitteln. Nach der Aufnahme wird das Molekül wieder dunkel, so dass nun weitere, benachbarte Moleküle angeknipst und aufgenommen werden können. Dieser Vorgang wird vielfach wiederholt, bis aus den vielen Pünktchen ein Bild entsteht. So lässt sich die Verteilung rekonstruieren - mit einer Auflösung, die nicht von der Licht-Wellenlänge begrenzt wird.
Nun haben die Forscher auch eine Substanzklasse gefunden, die alle Anforderungen dieses Konzepts erfüllt: Rhodaminamide. Herzstück der Moleküle ist ein System aus fünf Ringen. In dieser Form ist die Verbindung farblos und fluoresziert nicht. Lichteinstrahlung erzeugt eine Isomerisierung, bei der einer der Ringe geöffnet wird. In dieser Form ist das Molekül rot und kann mehrfach hintereinander angeregt werden.
Der Clou ist nun: Rhodaminamide lassen sich entweder durch ein UV-Photon anknipsen oder durch zwei Photonen im roten Bereich. Diese 2-Photonen-Anregung kann auf eine dünne Ebene fokussiert werden. Eine biologische Probe lässt sich so Ebene für Ebene aufnehmen und die einzelnen Aufnahmen zu einem Schichtbild rekonstruieren, wobei in der Fokalebene Auflösungen weit unterhalb der Beugungsgrenze (10-30 nm) erreicht werden.
Originalveröffentlichung: Stefan W. Hell et al.; "Photochromic Rhodamines Provide Nanoscopy with Optical Sectioning"; Angewandte Chemie 2007, 119, No. 33, 6382-6386.