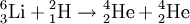Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
IsotopIsotope sind Nuklide (Atomsorten) mit gleicher Ordnungszahl, aber unterschiedlicher Massenzahl. Der Name (griech. ισο [iso] – gleich, τόπος [topos] – Ort) kommt daher, dass Isotope eines und des selben Elements im Periodensystem am gleichen Ort stehen. In der Nuklidkarte erscheinen sie jedoch getrennt. Isotope enthalten also in ihren Atomkernen eine gleiche Anzahl von Protonen, aber verschiedene Anzahlen von Neutronen. Der Begriff Isotop wurde von Frederick Soddy geprägt, der für seine Arbeiten und Erkenntnisse im Bereich der Isotope und radioaktiven Elemente 1921 den Nobelpreis für Chemie erhielt. In der Regel besitzt jedes natürlich vorkommende Element ein oder wenige stabile Isotope, während seine übrigen Isotope radioaktiv (das heißt instabil) sind und früher oder später zerfallen. Es gibt jedoch auch Elemente, bei denen alle Isotope instabil sind. Weiteres empfehlenswertes Fachwissen
Schreibweise für IsotopeUm verschiedene Isotope eines Elementes zu kennzeichnen, wird die Massenzahl links oberhalb des Elementsymbols hinzugefügt. Optional kann die Kernladungszahl links unterhalb des Elementsymbols angegeben werden, sofern sie – z. B. bei Kernreaktionen – von Interesse ist: Im Fließtext wird dagegen oft einfach die Massenzahl an den Elementnamen mit Bindestrich angefügt. Also z. B. „Uran-235“ oder „Kohlenstoff-14“, da dies der Sprechweise entspricht und keine Kenntnis der Elementsymbole notwendig ist. Für die drei Wasserstoffisotope existieren eigene Namen und eigene Elementsymbole:
Tritt in der Bezeichnung noch ein m auf (z.B. 16m1N), so ist damit ein Kernisomer gemeint. Die Zahl hinter dem m ist dabei eine Nummerierung falls mehrere Kernisomere auftreten. Stabile IsotopeMit 10 stabilen Isotopen hat Zinn die meisten natürlich vorkommenden Isotope. Von 22 sogenannten Reinelementen existiert nur jeweils ein stabiles Isotop. Solche Elemente werden auch als anisotop bezeichnet. Dies sind: Beryllium, Fluor, Natrium, Aluminium, Phosphor, Scandium, Mangan, Cobalt, Arsen, Yttrium, Niob, Rhodium, Iod, Cäsium, Praseodym, Terbium, Holmium, Thulium, Gold. Thorium besitzt zwar nur ein natürliches Isotop, dieses ist aber nicht stabil. Die Halbwertszeit ist mit 1,4 · 1010 Jahren sehr lang. In einigen Lehrbüchern wird es, wie auch Bismut, als Reinelement aufgeführt. Neueren Untersuchungen zufolge ist das bisher für stabil gehaltene Isotop des Bismuts ein Alpha-Strahler mit extrem langer Halbwertszeit (1,9 · 1019 Jahre). Bekannteste IsotopeEin bekanntes Isotop ist das radioaktive 14C, das zur Altersbestimmung von organischen Materialien (Archäologie) benutzt wird (Radiokarbonmethode). Kohlenstoff (C) liegt hauptsächlich in den stabilen Isotopen 12C und 13C vor. Zur Untersuchung von Paläo-Temperaturen wird vor allem das Verhältnis zweier der stabilen Sauerstoffisotope, 18O und 16O herangezogen. Das Isotop 235U wird aus dem Natururan angereichert und als Brennstoff in Kernkraftwerken oder stärker angereichert in Kernwaffen verwendet. Die gleiche Verwendung hat 239Pu. In den meisten Kernwaffen findet dieses heute Verwendung, da es ohne Anreicherungsprozess aus abgebranntem Kernreaktorbrennstoff gewonnen werden kann. 238Pu wird wegen seiner radioaktiven Zerfallswärme in der Raumfahrt zur Stromerzeugung in Radioisotopengeneratoren verwendet, wenn Solarzellen in großer Sonnenentfernung nicht mehr einsetzbar sind. Chemische Reaktionen bei IsotopenIn ihren chemischen Reaktionen unterscheiden sich Isotope des gleichen Elements nur geringfügig. Ein Beispiel ist die Elektrolyse von Wasser, bei der vorzugsweise Wasser mit dem normalen 1H reagiert und in Wasserstoff und Sauerstoff zerlegt wird, während sich Wassermoleküle mit 2H (Deuterium, Schwerer Wasserstoff) im Restwasser anreichern. Grund hierfür sind die verschiedenen Nullpunktsenergien der Isotope. Dieser Unterschied in der chemischen Reaktivität ist bei Wasserstoff/Deuterium aufgrund des großen relativen Massenunterschieds besonders ausgeprägt; bei den meisten anderen Elementen sind diese Effekte um ein Vielfaches schwächer. Isotope in der Analytik(Siehe auch Isotopenuntersuchung) Auch an ihren Spektrallinien können bei hoher Auflösung verschiedene Isotope eines Elements unterschieden werden (Isotopieverschiebung). Die Isotopenzusammensetzung in einer Probe wird in der Regel mit einem Massenspektrometer bestimmt, im Fall von Spurenisotopen mittels Beschleuniger-Massenspektrometrie. Radioaktive Isotope können oft auch anhand ihrer Radioaktivität detektiert werden. Isotope spielen ferner eine Rolle in der NMR-Spektroskopie. So wird beispielsweise in der NMR-Spektroskopie organischer Verbindungen das 13C-Isotop spektroskopiert, da es im Gegensatz zum 12C einen detektierbaren Kernspin hat. Isotope werden auch in der Aufklärung von Reaktionsmechanismen oder Metabolismen mit Hilfe der sogenannten Isotopenmarkierung verwendet. Die Isotopenzusammensetzung des Wassers ist an verschiedenen Orten der Welt verschieden und charakteristisch. Diese Unterschiede erlauben es etwa bei Lebensmitteln wie Wein oder Käse, die Deklaration des Ursprungsortes zu überprüfen. Die Untersuchung von bestimmten Isotopen-Mustern (insbesondere 13C-Isotopen-Mustern) in organischen Molekülen wird als Isotopomeren-Analyse bezeichnet. Sie erlaubt unter anderem die Bestimmung intrazellulärer Stoffflüsse in lebenden Zellen. Darüberhinaus ist die Analyse von 13C/12C-, 15N/14N- sowie 34S/32S-Verhältnissen in der Ökologie heute weit verbreitet. Anhand der Fraktionierung lassen sich Stoffflüsse in Nahrungsnetzen nachverfolgen oder die Trophieebenen einzelner Arten bestimmen. Siehe auch
Kategorien: Nukleartechnik | Nuklid | Kernchemie |
|
| Dieser Artikel basiert auf dem Artikel Isotop aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |