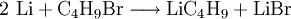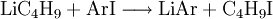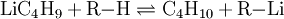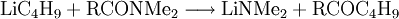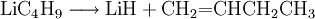Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Butyllithium
Unter Butyllithium versteht man in der Regel n-Butyllithium (n-BuLi), eine metallorganische Verbindung des Elements Lithium. Daneben gibt es noch die isomeren Formen sec-Butyllithium und tert-Butyllithium. Die Basizität nimmt in der Reihe n-Butyllithium < sec-Butyllithium < tert-Butyllithium zu. Dieser Artikel beschäftigt sich jedoch nur mit n-Butyllithium. Produkt-Highlight
Gewinnung und DarstellungDie Synthese erfolgt analog zur Herstellung von Grignard-Verbindungen durch Reaktion von 1-Brombutan mit Lithium (Pulver) in Diethylether: EigenschaftenPhysikalische EigenschaftenReines n-Butyllithium ist ein Feststoff und äußerst pyrophor. Daher ist es im Handel als leicht gelbe Lösung erhältlich, wobei Konzentrationen von 1,6 bis 10 mol/L in n-Hexan üblich sind. Ether-artige Lösungsmittel wie THF oder Diethylether sind als Lösemittel für n-BuLi ungeeignet, da sie langsam zersetzt würden. Chemische EigenschaftenDurch die große Elektronegativitätsdifferenz zwischen Kohlenstoff (2,55) und Lithium (0,98) ist die Bindung zwischen C und Li stark polarisiert. Aufgrund der Reaktionen von n-BuLi könnte man davon ausgehen, dass sich n-BuLi aus dem Butylanion und dem Lithiumkation zusammensetzt, also eine Ionenbindung besitzt.
Diese Annahme ist jedoch falsch: n-BuLi ist nicht ionisch. Als Feststoff und sogar als Lösung existiert n-BuLi, wie die meisten Organolithiumverbindungen, als Molekülgruppen mit kovalenten Bindungen zwischen Lithium und Kohlenstoff. Im Falle von n-Buli sind diese tetramerisch (in Ether) oder hexamerisch (in Cyclohexan) angeordnet.
ReaktionenLithium-Halogen-Austausch: Das Halogen in einer Verbindung kann gegen Lithium ausgetauscht werden. Dieses ergibt Reagenzien mit nukleophilen Kohlenstoffzentren, welche für die Herstellung von zahlreichen Verbindungen verwendet werden können. Den Austausch nimmt man in der Regel in Ether bei −78°C vor: Als starke Base (die konjugierte Säure ist Butan!) kann n-BuLi Amine und aktivierte C-H-Verbindungen deprotonieren: n-Buli kann für die Herstellung von bestimmten Aldehyden und Ketonen aus disubstituierten Amiden verwendet werden: Organolithiumverbindungen sind auch für die großtechnische Herstellung von Alkenen von Bedeutung. Wenn n-BuLi nämlich erhitzt wird, findet eine Elimination an der ß-Position statt, die zu Buten und Lithiumhydrid führt: Verwendungn-BuLi hat in der modernen synthetischen organischen Chemie große Bedeutung als ultrastarke Base bzw. als Lithiierungsreagenz erlangt. So wird z. B die häufig verwendete Base Lithiumdiisopropylamid (LDA) in der Regel in situ durch Deprotonieren von Diisopropylamin mit n-BuLi in THF hergestellt. SicherheitshinweiseWie bereits erwähnt, ist reines n-BuLi äußerst pyrophor. Aber auch die Lösungen, insbesondere wenn sie höher konzentriert sind, können sich spontan entzünden. Sie reagieren zudem heftig mit Wasser zu Lithiumhydroxid und Butan. Durch längeres Stehen kann sich daher in den Lösungen ein Niederschlag bilden, der durch Eindringen von Feuchtigkeit entsteht. Es kann sich aber auch um Lithiumhydrid handeln, da n-BuLi sehr langsam in Buten und LiH zerfällt. Quellen |
|||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Butyllithium aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||