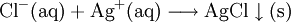Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ChlorideEin Chlorid ist in der Anorganik ein Salz der Chlorwasserstoffsäure, besser bekannt als Salzsäure (chemische Formel: HCl). Ein Chlorid enthält in seinem Ionengitter einfach negativ geladene Chlor(−I)-Ionen Cl− (meist Chloridionen genannt). In der Organik werden Derivate der verschiedensten Verbindungen als Chloride bezeichnet. So wird Methan, bei dem ein Wasserstoff-Atom gegen ein Chlor-Atom ausgetauscht (substituiert) wurde, Methylchlorid genannt. Hier liegt jedoch nicht wie bei den oben angesprochenen anorganischen Verbindungen Chlor als Chloridion vor, sondern ist kovalent mit dem Kohlenstoffatom verbunden. Chlorid ist ebenso die Kurzbezeichnung für das Chloridion und wird so in der Nomenklatur von Salzen verwendet. Weiteres empfehlenswertes Fachwissen
Nachweis (Qualitativ)Im Einzelnen: Zum Nachweis von Chlorid wird zunächst ein Auszug durchgeführt, vorteilhaft ist der Sodaauszug, da in dessen Filtrat nur noch Anionen gelöst vorkommen. Man säuert das Filtrat mit verdünnter Salpetersäure an (um das spätere, das Ergebnis zerstörende Ausfallen von Silbercarbonat zu verhindern) und gibt einige Tropfen Silbernitratlösung hinzu. Es entsteht ein weißer, ggf. käsiger Niederschlag von Silberchlorid, der sich bei Zugabe von verdünntem Ammoniakwasser unter Bildung des Diammin-Silber(I)-ions [Ag(NH3)2]+ löst. Führt man den Versuch ohne den Auszug durch, kann es sein, dass z. B. Kupferionen stören, weil eine Kupfer(II)-salzlösung bei Zugabe von Ammoniak tiefblau wird (aufgrund der Bildung des Amminkomplexes [Cu(NH3)4]2+). Nachweis (Quantitativ)Siehe: EigenschaftenAnorganische ChlorideChloride sind farblose oder farbige Salze, die in unterschiedlichsten Kristallstrukturen vorkommen können. Sie haben sehr hohe Schmelz- und Siedepunkte. Als Schmelzen oder in Lösung leiten sie den elektrischen Strom. Chloride lösen sich in protischen und polaren Lösungsmitteln. EntstehungAnorganische ChlorideChloride entstehen bei der Reaktion von Metallen mit elementarem Chlor oder mit Salzsäure (nur, wenn sie in der Spannungsreihe unterhalb des Wasserstoffes stehen, da Salzsäure nicht oxidierend wirkt). Sie entstehen aber auch bei der Reaktion von Hydroxiden, Metalloxiden, Carbonaten, Hydrogencarbonaten und allgemein von Salzen schwächerer Säuren mit Salzsäure. Organische ChlorideDurch Substitutions- und Additionsreaktionen an Kohlenwasserstoffen sowie Carbonsäuren und ihren Derivaten können Chloride gewonnen werden. Verwendung
BeispieleBekanntestes Beispiel für ein Chlorid ist das Natriumchlorid, besser bekannt als Kochsalz (chemische Formel: NaCl). Wichtige Chloride sind:
Sehr viele Chloride bilden auch Hydrate. Weitere Informationen
Kategorien: Stoffgruppe | Chlorid |
|
| Dieser Artikel basiert auf dem Artikel Chloride aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |