Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Wasserstoffperoxid
Wasserstoffperoxid (H2O2) ist eine blassblaue, in verdünnter Form farblose, weitgehend stabile Flüssigverbindung aus Wasserstoff und Sauerstoff. Es ist etwas viskoser als Wasser, eine schwache Säure und gegenüber den meisten Stoffen ein sehr starkes Oxidationsmittel, das als solches heftig mit Substanzen wie z. B. Kupfer, Messing, Kaliumiodid reagiert und somit als starkes Bleich- und Desinfektionsmittel fungiert. In hochkonzentrierter Form ist es sowohl als Einzel- als auch als Komponentenraketentreibstoff einsetzbar. Weiteres empfehlenswertes Fachwissen
Physikalische EigenschaftenDas H2O2-Molekül ist gewinkelt (Diederwinkel = 111°). Wegen der starken Vernetzung durch Wasserstoffbrücken ist reines Wasserstoffperoxid sehr viskos. Da hochkonzentriertes (= nahezu wasserfreies) H2O2 instabil ist und spontan unter Explosion zerfällt, insbesondere wenn es mit Metallen in Berührung kommt, gelangt es normalerweise als maximal 35 %ige Lösung in Wasser frei verkäuflich in den Handel. Für den Industriebedarf gibt es aber auch Konzentrationen von 50 % H2O2 in Wasser. Bei Berührung mit über 20 %iger Wasserstoffperoxidlösung können Verätzungen auftreten. Beim Umgang sind daher Schutzhandschuhe zu tragen. HerstellungFrüher wurde Wasserstoffperoxid hauptsächlich durch Elektrolyse von Schwefelsäure hergestellt. Dabei bildet sich Peroxodischwefelsäure, die dann wieder zu Schwefelsäure und Wasserstoffperoxid hydrolysiert wird. Heute wird Wasserstoffperoxid technisch durch das Anthrachinon-Verfahren hergestellt. Dazu wird Anthrahydrochinon mit Luftsauerstoff unter Druck zu Wasserstoffperoxid und Anthrachinon umgesetzt. Anthrachinon kann im nächsten Schritt erneut mit Wasserstoff zum Anthrahydrochinon reduziert werden, usw. Die Bruttogleichung lautet: Im Labormaßstab wird Wasserstoffperoxid auch bei der Behandlung von Peroxiden mit Säuren hergestellt. Ein historisch wichtiges Reaganz ist Bariumperoxid, dass in einer schwefelsauren Lösung zu Wasserstoffperoxid und Bariumsulfat reagiert. Die molaren Bildungsenthalpien betragen:
Chemische EigenschaftenWasserstoffperoxid neigt dazu, in Wasser und Sauerstoff zu zerfallen. Dabei wird eine Energie von 98,02 kJ/mol freigesetzt:
Diese Zersetzungsreaktion wird unter anderem durch Mn2+- (siehe Nachweis) oder andere Schwermetallionen, I−- und OH−-Ionen katalysiert. Daher werden H2O2-Lösungen im Handel mit Stabilisatoren (unter anderem Phosphorsäure) versetzt. Es ist ein starkes Oxidationsmittel. Unter Verminderung der Oxidationsstufe von −I auf −II entstehen als Reaktionsprodukte nur Wasser und Sauerstoff. Schwer abzutrennende oder störende Nebenprodukte fallen nicht an, was seine Anwendung im Labor vereinfacht. Gegenüber stärkeren Oxidationsmitteln (beispielsweise Kaliumpermanganat) kann es auch als Reduktionsmittel wirken. Wasserstoffperoxid ist eine sehr schwache Säure; seine anorganischen Salze und organischen Ester sind die Hydroperoxide und Peroxide. NachweisZum qualitativen Nachweis werden zur neutralen Probelösung Mn2+-Ionen (beispielsweise MnSO4) zugegeben. Entwickelt sich Gas, wird mit der Glimmspanprobe auf Sauerstoff geprüft. Fällt diese positiv aus, indem der Glimmspan aufglüht, war H2O2 zugegen.
Aus der Festprobe machen. Chromtrioxid CrO3 ergibt mit Wasserstoffperoxid im stark sauren Bereich (pH < 0) das intensiv blau gefärbte Chromperoxid, welches sich in Ether löst. Hierzu Kaliumdichromat mit verd. H2SO4 ansäuern und 1 cm hoch mit Ether überschichten (Abzug!), Probe dazu geben und schütteln. Die Ether-Phase färbt sich bläulich.
Der Nachweis mit „Titangelb“ (nicht zu verwechseln mit einem Farbstoff gleichen Namens) ist ein sehr empfindlicher. (Farblose) Titan(IV)-Ionen ergeben schon mit Spuren von Wasserstoffperoxid das intensiv orangegelb gefärbte Peroxotitanyl-Ion. Umgekehrt kann man daher auch mit Wasserstoffperoxid eine Substanz auf Titan(IV) prüfen.
Zur Bestimmung der Konzentration in wässrigen Lösungen, z. B. Bleichbädern. Die Bestimmnung erfolgt oximetrisch mit n/10 Kaliumpermanganat-Lösung in schwefelsaurer Lösung (Umschlag bis zur bleibenden schwach rosa Färbung (ca. 1 min. anhaltend) nach folgender Gleichung: PhysiologieWasserstoffperoxid wirkt stark ätzend, besonders als Dampf. Falls man Wasserstoffperoxid auf die Haut bekommt, sollte man die Stelle mit Wasser gut spülen (Verdünnung), oder zumindest sofort von der Haut entfernen. Es tötet die Hautzellen schnell ab, diese färben sich dann weiß. Allgemein wirkt Wasserstoffperoxid zytotoxisch und durch seine starke Toxizität gegenüber vielen prokaryontischen Kleinstlebewesen desinfizierend. Wasserstoffperoxid entsteht bei zahlreichen biochemischen Prozessen. Im biologischen Kreislauf entsteht es durch die oxidative Metabolisierung von Zucker. Der Organismus schützt sich gegen seine toxische Wirkung mithilfe von Enzymen – Katalasen, Peroxidasen –, die es wieder zum ungiftigen O2 und H2O zersetzen. Die weibliche Eizelle produziert nach der Befruchtung durch ein Spermium kurzzeitig Wasserstoffperoxid in geringer Konzentration, um andere Spermien abzutöten. Zudem stellt Wasserstoffperoxid ein Signalmolekül für die Induktion der pflanzlichen Abwehr von Pathogenen dar (Aspekt der Zytotoxizität). VerwendungBleichmittelWasserstoffperoxid ist ein Bleichmittel, daher wird es in der Kosmetik zum Blondieren von Haaren und zum Bleichen von Zähnen benutzt. Häufig wird es dabei als an Carbamid gebundenes Peroxid eingesetzt.
Weltweit ist die größte Anwendung in der umweltfreundlichen Bleiche von Zellstoff zu sehen. Zellstoff wird aus Holz gewonnen und das darin enthaltene Lignin mit H2O2 gebleicht. Hauptverwendung von Zellstoff ist die Herstellung von Papier, Servietten, Taschentüchern etc. Im Handwerk wird Wasserstoffperoxid zum Bleichen – also zur Aufhellung – von Hölzern benutzt, z. B. bei der Restaurierung oder der Renovierung. Wasserstoffperoxid bzw. wasserstoffperoxidhaltige Bleichmittel, wie etwa ein Peroxyessigsäure-Wasserstoffperoxid-Gemisch, werden in der Werbesprache auch mit dem Kunstwort Aktiv-Sauerstoff bezeichnet. Desinfektion und SterilisationZur Desinfektion wird Wasserstoffperoxid als dreiprozentige Lösung im Mund- und Rachenraum eingesetzt, z. B. in der Zahnmedizin; auch zur Desinfektion von Kontaktlinsen in Kontaktlinsenreinigern und zur Entkeimung von Packstoffen wird es benutzt sowie zur Händedesinfektion. Es wird auch in Hautcremes für das Gesicht, zur Öffnung der Poren und somit zur Bekämpfung von Pickeln und Hautverunreinigungen eingesetzt. Häufig findet es Anwendung bei der Reinigung von industriellen Abwässern und in der Schwimmbadetechnik bei der Desinfektion des Wassers. In der Lebensmittelindustrie wird 30 %iges Wasserstoffperoxid in aseptischen Abfüllanlagen zur Sterilisation von PET-Flaschen verwendet. Zahlreiche Lebensmittel (Getränke, Milch, Milchprodukte, Soßen, Suppen u. a.) werden heute zur besseren Haltbarkeit und Produktqualität in Kartons, Becher, Flaschen und Folien aseptisch abgepackt. Der dabei am häufigsten angewendete Prozess beruht auf einer Sterilisation mit konzentriertem Wasserstoffperoxid (35 %). Die hohe bakterizide Wirkung von H2O2, die Umweltverträglichkeit und die gute technische Realisierbarkeit sind die Gründe für die weite Verbreitung dieses Verfahrens. In der betrieblichen Praxis unterscheidet man zwischen dem Sprüh- und dem Tauchbadverfahren. SauerstoffzuführungWasserstoffperoxid kann in Aquarien zum Zuführen von Sauerstoff benutzt werden. Die Sauerstofferzeugung geschieht in einem Oxidator. Dazu wird in einem Gefäß im Aquarium Wasserstoffperoxid mit Hilfe eines Katalysators in Wasser und Sauerstoffradikale gespalten. Nutzung mehrerer Wirkungen gleichzeitigBei der Innenrenovierung kann Wasserstoffperoxid dazu verwendet werden, Schimmelpilzbefall zu bekämpfen. Es kann sowohl – als Desinfektionsmittel – die biologisch aktiven Zellen abtöten (Fungizid) als auch die Sporen zerstören (Sporizid). Als Bleichmittel kann es auch nicht entfernte Rückstände des Belags – auf weißem porösem Untergrund – „optisch unschädlich“ machen. Wasserstoffperoxid ist dabei Alkohol oder Chlorbleichlauge vorzuziehen, da diese Stoffe Nebenprodukte, wie z. B. Salze im Untergrund, erzeugen können. Alkohol ist gegenüber Wasserstoffperoxid auch weder sporozid noch bleichend. Auch bei der Präparation von Knochen dient Wasserstoffperoxid zum Bleichen und Desinfizieren. In der Zahnmedizin wird H2O2 zur lokalen Desinfektion des Zahngewebes und zur Blutstillung bei kleineren Eingriffen verwendet. In der Landwirtschaft wird Wasserstoffperoxid zur Desinfektion von Gewächshäusern und zur Sauerstoffanreicherung in Nährlösungen von Hydrokulturen benutzt. BiologieFür die Bestimmung von Bakterienkulturen wird der Katalase-Test mit 3 %iger Wasserstoffperoxidlösung durchgeführt. Die meisten aeroben und fakultativ anaeroben Bakterien wie auch Pilze haben das Enzym Katalase, welches imstande ist, das für die Zellen giftige H2O2 zu spalten. Wasserstoffperoxid kann in der Forensik zum Nachweis von Blut verwendet werden. Louis Jacques Thenard entdeckte 1818, dass die Peroxidase im Hämoglobin Wasserstoffperoxid zersetzt. Christian Friedrich Schönbein entwickelte daraus 1863 einen Test auf Blut. Heute wird jedoch der empfindlichere Kastle-Meyer-Test zum Nachweis von Blut verwendet. Experimentell wird Wasserstoffperoxid in der Biologie zur Herbeiführung des programmierten Zelltodes von isolierten eukaryontischen Zellen genutzt. ÄtzmittelIn der Mikroelektronik benutzt man das Gemisch von Schwefelsäure und Wasserstoffperoxid – „Piranha“ genannt – zur Reinigung der Oberfläche von Wafern und zur Erzeugung einer dünnen, etwa 3–4 nm dicken hydrophilen Oxidschicht auf den Wafern. Heutzutage ist die Bezeichnung „SPM“ (Sulphuric Peroxide Mixture) geläufiger. Die Hauptanwendung ist das Entfernen von Fotolacken. Bei der Herstellung von gedruckten Leiterplatten (Platinen) werden Kupferchlorid-Ätzbäder zum Entfernen des Kupfers verwendet:
Zur Regeneration der Kupferchlorid-Ätzbäder wird Wasserstoffperoxid zusammen mit Salzsäure eingesetzt:
Dabei werden die Wasserstoffperoxid- und Salzsäurezugabe über das Redoxpotential gesteuert. Raketen-/TorpedotriebwerkeAls Energie- beziehungsweise Sauerstofflieferant (Zersetzung etwa über Braunstein) kam es in konzentrierter Form bei Raketenantrieben (etwa: Max Valier, Messerschmitt Me 163) und U-Boot-Antrieben (Walter-U-Boot) zum Einsatz. Auch wurde – mit Hilfe von Kaliumpermanganat zersetztes – Wasserstoffperoxid als Treibgas für die Treibstoffpumpen (500 PS Leistung) der A4 verwendet. Unzersetztes Wasserstoffperoxid wurde als bei Normaltemperatur flüssiger Sauerstoffträger in britischen Raketen (z. B. Black Arrow) benutzt und verbrannte dort mit Kerosin. Wasserstoffperoxid neigt zu unkontrollierter Zersetzung. So starben am 16. Juli 1934 Dr. Kurt Wahmke und zwei Techniker in Kummersdorf bei der Explosion eines mit Wasserstoffperoxid betriebenen Triebwerkes. Aufgrund der Gefährlichkeit in Einsatz und Handhabung (Ätzwirkung, unkontrollierte Zersetzung, Explosion bei Verunreinigungen in Tank und Leitungssystem) ist der Gebrauch heute auf Kleinraketentriebwerke (Rekordversuche, Steuertriebwerke) beschränkt. Der Untergang des russischen Atom-U-Boots Kursk im Jahre 2000 wurde Gerüchten zufolge durch Auslaufen von Wasserstoffperoxid aus einem Tank in einem Torpedo und die anschließende Reaktion mit Kupferteilen verursacht, die zum Zerbersten des Torpedos führte. SprengstoffherstellungWasserstoffperoxid reagiert in Anwesenheit eines geeigneten Katalysators mit Aceton zu Acetonperoxid. Acetonperoxid ist ein Sprengstoff, der aber wegen seiner sehr unsicheren Handhabung nicht kommerziell verwendet wird. Genauer wird Acetonperoxid auch als Triaceton-Triperoxid bezeichnet, abgekürzt TATP. Zu weiteren mit Wasserstoffperoxid hergestellten Sprengstoffen zählt Hexamethylentriperoxiddiamin (HMTD). Experten des Fraunhofer-Instituts für Chemische Technologie zufolge wird TATP bei den meisten Selbstmordattentaten in Israel verwendet.[3] Die Anschläge vom 7. Juli 2005 auf die Londoner U-Bahn (55 Tote) sollen ebenfalls mit TATP verübt worden sein. Schließlich wurden am 4. September 2007 drei in Pakistan ausgebildete Islamisten im sauerländischen Oberschledorn festgenommen, die TATP aus 730 Kilogramm einer 35 %igen Wasserstoffperoxidlösung herstellen wollten, um US-Einrichtungen bzw. von US-Bürgern frequentierte Restaurants in Deutschland anzugreifen.[4][5][6] Andererseits ist Experten nicht in Einzelheiten bekannt, wie Terroristen mit Wasserstoffperoxid hergestelltes TATP kontrolliert zur Explosion bringen könnten. Vor allem wurde zu einem 2007 in London vereitelten Versuch, Flüssigsprengstoff in ein Flugzeug zu schmuggeln, bezweifelt, dass an Bord geeignetes Acetonperoxid mithilfe eingeschmuggelter Fläschchen mit Wasserstoffperoxid und Aceton hergestellt werden könnte.[7] Literatur
Quellenangaben
Kategorien: Brandfördernder Stoff | Ätzender Stoff | Wasserstoffverbindung | Sauerstoffverbindung | Arzneistoff |
||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Wasserstoffperoxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||







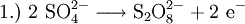
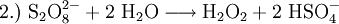
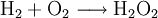
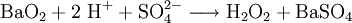
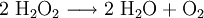
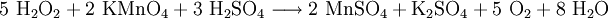
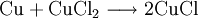 .
.
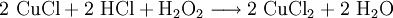 .
.


