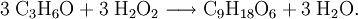Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Acetonperoxid
Acetonperoxid (auch bekannt als APEX oder TATP) ist ein hochexplosiver Stoff mit der Schlagempfindlichkeit eines Initialsprengstoffs. Wie die meisten organischen Peroxide ist auch Acetonperoxid instabil und kann durch Stoß, Wärme, Reibung, Funken, Elektrizität oder UV-Licht zerfallen und heftig detonieren, ist aber im Unterschied zu weniger gefährlichen Peroxiden wie Dibenzoylperoxid viel empfindlicher gegen Schlag und Wärme. Man unterscheidet dimeres, trimeres und tetrameres Acetonperoxid, welche unter unterschiedlichen Bedingungen (z. B. in Abhängigkeit vom benutzten Katalysator) gebildet werden. Alle Acetonperoxide sind hochexplosiv und bergen dadurch ein hohes Gefahrenpotential. Acetonperoxid sollte nach ersten Angaben der Sicherheitsbehörden (von APEX war in späteren Stellungnahmen keine Rede mehr) bei den Anschlägen auf Londoner Flugzeuge im Jahr 2006 verwendet werden; allerdings ist es unwahrscheinlich, dass es den Terroristen gelungen wäre, den Sprengstoff rechtzeitig zu trocknen. Produkt-Highlight
Eigenschaften
BildungTrimeres Acetonperoxid (Schmelzpunkt 97 – 131,5 °C) entsteht bei Einwirken von Wasserstoffperoxid auf Aceton in Gegenwart verdünnter Säuren als Katalysator: [2][3] Bei Anwesenheit von Salzsäure, Schwefelsäure oder Phosphorsäure verlaufen die Reaktionen stark exotherm (Explosionsgefahr). Bei mangelnder Kühlung entsteht bei der Reaktion mit Salzsäure unter Kochen das Tränengas Chloraceton. Die Herstellungsmöglichkeit des dimeren Produktes besteht in der Umsetzung von Aceton mit Peroxomonoschwefelsäure (Carosche Säure)[4] und die Oxidation von Diisopropylether durch Luftsauerstoff oder bei einer Ozonolyse. Bei unsachgemäßer Lagerung von Diisopropylether kann daher Acetonperoxid entstehen. Zur Vernichtung solcher Peroxide werden Kupfer(I)-Verbindungen zur Reduktion eingesetzt. Tetrameres Acetonperoxid wurde vor wenigen Jahren in obiger Reaktion bei Verwendung von Lewis-Säuren als Katalysator gewonnen. Acetonperoxid kann in erheblichen Mengen beim bloßen Vermischen von Aceton mit Wasserstoffperoxid-haltigen Lösungen nach mehrtägiger Lagerung des Gemischs entstehen. So entdeckte es der Berliner Chemiker Richard Wolffenstein bereits 1895. Besondere GefahrenAcetonperoxid besitzt mehrere Peroxid-Gruppen pro Molekül und ist wie andere, ähnlich gebaute Peroxide äußerst explosiv. Trimeres Acetonperoxid sublimiert schon bei 14–18 °C, also unterhalb der Raumtemperatur, und detoniert feucht noch bei einem Wassergehalt von 25 %. Bereits bei 130 °C kann es explodieren. Bei einer Lagerung bei erhöhter Temperatur zersetzt es sich innerhalb weniger Stunden. Auch Reibung und Stoß zwischen zwei harten Materialien, das bloße Öffnen des Gefäßes oder kleinste Funken (z. B. einer elektrostatischen Aufladung) bringen das Peroxid zur Explosion. Entsprechend ist auch das Befüllen von Rohren gefährlich. Es reicht beispielsweise schon die beim Öffnen eines Schraubverschlusses entstehende Reibungsenergie aus, um ein in das Gewinde gelangtes Korn zur Explosion zu bringen, was das gesamte Behältnis zur Explosion bringen würde. Bei Raumtemperatur bilden sich durch Sublimation des Acetonperoxids bereits nach wenigen Tagen im Bereich des Gefäßverschlusses Kristalle, die beim Öffen explodieren können. Die Sprengkraft von Acetonperoxid liegt, je nach Testmethode, bei 80–100 % der Sprengkraft von Trinitrotoluol (TNT) und übertrifft damit die von Initialsprengstoffen wie Quecksilberfulminat. Bei direkter Berührung eines Kristalls mit einer Flamme erfolgt jedoch bei diesen Peroxiden meist nur eine relativ harmlose Verpuffung. Bei der Explosion von Acetonperoxid entstehen die für die Sprengwirkung verantwortlichen Gasmoleküle ohne die bei vielen Sprengstoffen übliche Hitzeentwicklung. In einem Fallhammerversuch mit einem 1 kg-Fallhammer (üblich sind bei normalen Sprengstoffen Untersuchungen mit einem 2 kg-Fallhammer) detoniert es bei Schlag aus nur 3 cm Höhe. Acetonperoxid ist damit einer der schlagempfindlichsten Stoffe und deutlich empfindlicher als übliche Initialsprengstoffe oder beispielsweise Nitroglycerin (2 kg Fallhammer aus 10–12 cm Höhe). Nitroglycerin hat eine Reibungsempfindlichkeit von nur 0,2 Nm, TATP aber eine von 0,3 Nm, wonach Nitroglycerin empfindlicher ist. Wenngleich Acetonperoxid leicht herstellbar ist und sich Experimente damit speziell bei Jugendlichen einer gewissen Beliebtheit erfreuen (Slangname auch „Apex“), ist dieser Stoff außerordentlich instabil und gefährlich und unterliegt darüber hinaus dem Sprengstoffrecht (insbesondere der Erlaubnispflicht des § 27 Sprengstoffgesetz[5], sofern keine Ausnahmen nach der 1. Verordnung zum Sprengstoffgesetz für Forschung und Lehre greifen). Als chemisches Experiment wird an Schulen und Universitäten gelegentlich das Erhitzen weniger Milligramm feuchten trimeren Acetonperoxids frei auf einer stabilen Eisenplatte bis zum Detonieren des Peroxids vorgeführt. Hier sollte besser auf das Hexamethylentriperoxiddiamin (HMTD) ausgewichen werden, das bei geringerer Schlagempfindlichkeit und fehlender Tendenz zur Sublimation den gleichen didaktischen Vorführungswert hinsichtlich der Verpuffung oder Detonation hat. Acetonperoxid lässt sich nicht mit herkömmlichen, auf Nitroverbindungen empfindlichen Sprengstoffdetektoren detektieren. GeschichtlichesAcetonperoxid wurde im Jahre 1895 von Richard Wolffenstein an der Technischen Hochschule Berlin bei der Untersuchung der Oxidation von Coniin mit Wasserstoffperoxid in Aceton als Lösungsmittel zufällig entdeckt. Ein Herstellungsverfahren für Acetonperoxid wurde von ihm im Jahre 1895 unter der Nummer D.R.P. 84953 in Deutschland zum Patent angemeldet. Baeyer und Villiger publizierten im Jahre 1899 und 1900 einige Artikel über die Bildung dimeren und trimeren Acetonperoxids. Im Jahre 1925 wurde es zwar unter der Nummer D.R.P. 423,176 in Deutschland und verschiedenen anderen Ländern von den Sprengstoffwerken Dr. R. Nahnsen & Co. AG, Hamburg als angeblich sicherer und stabiler Initialsprengstoff zum Patent angemeldet. Die extreme Schlagempfindlichkeit, Flüchtigkeit (6,5 % in 24 h bei 14–18 °C) und mangelnde Stabilität verhinderten jedoch jegliche praktische Nutzung (vgl. Rohrlich/Sauermilch) aufgrund der großen Gefährlichkeit. A. E. Thiemann schlug im Jahre 1942 die Nutzung dimeren und trimeren Acetonperoxids als Zusatz zur Verbesserung der Zündwilligkeit des Dieselkraftstoffs vor. Tetrameres Acetonperoxid wurde erst im Jahre 1999 von chinesischen Forschern entdeckt. Acetonperoxid sorgte immer wieder aufgrund unbeabsichtigter Bildung für spektakuläre Arbeitsunfälle, so z. B. 2001 in einem Labor an der Universität Bonn, wo ein 55-Liter-Abfallfass mit Chemikalienabfällen gefüllt wurde, die Acetonperoxid bilden konnten. Allerdings erfolgte hier kein Nachweis, ob tatsächlich eine Peroxidbildung erfolgt war.[6] [7] Bei einem geplanten Anschlag auf mehrere Flugzeuge während des Fluges in die USA, der am 10. August 2006 in London verhindert werden konnte, sollte möglicherweise Acetonperoxid verwendet werden.[8] Die Attentäter hätten die Rohstoffe (Aceton und Wasserstoffperoxid) in flüssiger Form in Trinkgefäßen in die Flugzeuge schleusen und dort den Sprengstoff ohne weiteren Katalysator herstellen können. [8] Die Praktikabilität eines solchen Unterfangens wird von Experten jedoch bezweifelt, da man zusätzlich eine dritte Flasche mit Salz- oder Schwefelsäure benötigen würde. [9]Ohne Säurekatalyse erfolgt selbst nach mehrwöchigen Stehen der Mischung aus Aceton und Wasserstoffperoxid keine Reaktion, wie schon Wolffenstein 1895 nachweisen konnte. Auch müsste das Peroxid nach der Herstellung von der Lösung abfiltriert werden. Die nachfolgende nötige Trocknung würde mehrere Stunden auf dem Filter dauern. Somit ist die „Flugzeugvariante“ in dieser Ausführung sehr unwahrscheinlich.
Acetonperoxid kann am besten in Aceton und unter dessen Lösungsvermittlung in Diesel oder Biodiesel eingebracht werden. Aber auch die Löslichkeit in Aceton ist beschränkt und dürfte die 25 % nicht überschreiten. In Dieselkraftstoff oder Pflanzenöl erhöht es die Cetanzahl. Da es preisgünstigere und ungefährlichere Lösungen gibt, wird es für diesen Zweck nicht verwendet. Literatur
Quellenangaben
Kategorien: Peroxid | Sprengstoff |
||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Acetonperoxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||