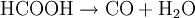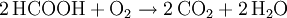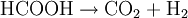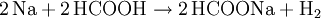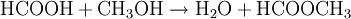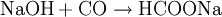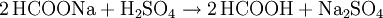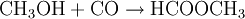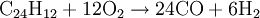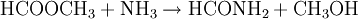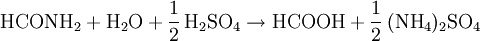Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Ameisensäure
Ameisensäure (nach der Nomenklatur der IUPAC Methansäure genannt, eng: formic acid, lat: acidum formicum) ist eine farblose, ätzende und in Wasser lösliche Flüssigkeit, die in der Natur vielfach von Lebewesen zu Verteidigungszwecken genutzt wird. Sie zählt zu den gesättigten Carbonsäuren und ist mit der strukturierten Summenformel HCOOH die einfachste Carbonsäure. Die Ameisensäure wurde im Jahre 1671 von John Ray erstmals aus roten Ameisen isoliert und erhielt von diesen ihren Namen. Ein weiterer Trivialname für Methansäure, Formylsäure, geht auf das lateinische Wort für Ameise, formica, zurück. Produkt-Highlight
Aufbau und NomenklaturAmeisensäure ist die einfachste Carbonsäure und kurzkettigste Alkansäure, die Carboxylgruppe (-COOH) bestimmt besonders stark ihre Eigenschaften. Das Kohlenstoffatom hat eine formale Oxidationsstufe von +2. Es kann deswegen analog zu den Carbonylverbindungen als Hydridüberträger wirken, daher rührt ihre reduzierende Wirkung. Aufgrund der stark polaren Carboxylgruppe ist Ameisensäure in jedem Verhältnis mit Wasser mischbar. Ameisensäure, ein historisch bedingter Name, der auf das Vorkommen in Ameisen hinweist, ist der wesentlich häufiger verwendete Name. Die Salze der Ameisensäure heißen Methanoate - auch hier wird der Trivialname Formiate häufiger benutzt, obwohl er nicht der Nomenklatur entspricht. Die Formiate haben die strukturierte Summenformel (HCOO)nMe, wobei n der Wertigkeit des Metall-Ions entspricht. Beispiele von Formiaten sind Natriumformiat (HCOONa) und Aluminiumformiat [(HCOO)3Al)]. EigenschaftenAmeisensäure riecht stark und stechend. Die Geruchsschwelle liegt bei 1 ml/m³. Mit Wasser, Ethanol sowie Glykol ist Ameisensäure in jedem Verhältnis mischbar. In den meisten anderen polaren organischen Stoffen ist sie ebenfalls löslich, in Kohlenwasserstoffen nur in geringen Mengen. Ameisensäure ist eine relativ instabile, farblose, klare und leicht flüchtige Flüssigkeit. Bei 8 °C erstarrt die Ameisensäure zu einem farblosen Feststoff. Bei 100,7 °C siedet sie. Schmelz- und Siedepunkt liegen wesentlich höher als die von organischen Verbindungen mit ähnlichen molaren Massen (beispielsweise Methanol), da beim Schmelzen und Sieden auch Wasserstoffbrückenbindungen zwischen den einzelnen Molekülen aufgebrochen werden müssen. Diese bestehen teilweise auch im gasförmigen Zustand weiter, weswegen Ameisensäure stark vom Verhalten eines idealen Gases abweicht. In Anwesenheit von Sauerstoff verbrennt sie zu Kohlenstoffdioxid und Wasser. Die Ameisensäure ist ein starkes Reduktionsmittel, weil die deprotonierte Säure sich zu Wasserstoff und Kohlenstoffdioxid spaltet. Die Ameisensäure hat eine Dichte von 1,22 g·cm−3 bei 20 °C. Die Säurekonstante (pKs-Wert) ist 3,75. Sie ist die stärkste unsubstituierte Monocarbonsäure. Zum Vergleich: Chlorwasserstoffsäure hat einen pKs-Wert von −7, Schwefelsäure von −3. Zum Schmelzen der Ameisensäure werden 12,7 kJ/mol benötigt, zum Verdampfen 22,7 kJ/mol. Der Tripelpunkt liegt bei 8,3 °C und 0,0236 bar. Der Nachweis des Ameisensäuredampfes erfolgt mit Hilfe von Dräger-Prüfröhrchen. Ansonsten wird die Ameisensäure über ihre reduzierende Wirkung nachgewiesen, meist dadurch, dass sie eine ammoniakalische Silbernitratlösung zu Silber reduzieren kann. Thermodynamische EigenschaftenDie Standardbildungsenthalpie ΔfH0liquid beträgt −424,72 kJ·mol−1, ΔfH0gas beträgt −378,6 kJ·mol−1. Die Standardentropie S0liquid ist 128,95 J·mol−1·K−1, S0gas 248,7 J·mol−1·K−1. Die Wärmekapazität der Flüssigkeit wird mit 99,04 J·mol−1·K−1, die des Gases mit 45,7 J·mol−1·K−1 angegeben. Reaktionen
Mit Metallen reagiert Ameisensäure zu Metallformiaten und Wasserstoff:
Mit Alkoholen reagiert Ameisensäure in Anwesenheit eines Katalysators (meist Schwefelsäure) zu Wasser und Ameisensäurealkylestern (Methylester).
VerwendungAmeisensäure wurde unter der E-Nummer E236 als Konservierungsmittel in Fisch-, Obst- und Gemüseprodukten verwendet, was aber seit 1998 in Deutschland gesetzlich verboten ist. Auch Natrium- und Calciumformiat werden als Konservierungsmittel verwendet (E237 und E238). In der Medizin wird sie als Antirheumatikum verwendet, in der Textil- und Lederindustrie zum Beizen und Imprägnieren. Teilweise wird sie auch als Desinfektionsmittel (auch in sauren Reinigungsmitteln) verwendet. Sie tötet Bakterien gut ab. Allerdings kann sie dabei auch mit anderen Stoffen in Reaktion treten. In der chemischen Industrie wird sie zur Neutralisation, bei der Gummiproduktion und allgemein in der organischen Synthese genutzt. In der Elektronikproduktion wird Ameisensäure als Reduktionsmittel beim Lötprozess verwendet. Imker benutzen sie zur Behandlung der Bienen gegen die Varroamilbe und in privaten Haushalten wird Ameisensäure häufig zum Entkalken von Waschmaschinen verwendet. In der Genetik kann man Ameisensäure in Verbindung mit dem Enzym AP-Endonuclease nutzen, um zufällig Insertionsmutanten herzustellen, die sogenannte In-Vitro-Mutagenese. Des Weiteren ist Ameisensäure als ein Bestandteil des Tabakrauches zu finden. Auf Flughäfen wird sie zum Enteisen der Landebahnen genutzt, da Salz, das in anderen Bereichen zu diesem Zweck verwendet wird, Korrosion an Flugzeugen hervorrufen würde. In der Kunststoffindustrie wird sie zum Verkleben von Polyamid-Kunststoffen verwendet. Konzentrierte Ameisensäure wird zum Säubern von Rohedelsteinen benutzt, da sie Kalkstein und andere Verunreinigungen stark angreift und so den Edelstein freilegt, ohne dass dieser beschädigt wird. Dieses Reinigungsverfahren sollte nur bei säurebeständigen Edelsteinen angewandt werden. Historische InformationenIm frühen 15. Jahrhundert beobachteten einige Alchemisten und Naturalisten, dass Ameisen eine saure Flüssigkeit absondern. Der englische Naturalist John Ray isolierte 1671 als Erster die Ameisensäure, indem er eine große Anzahl von Ameisen destillierte. Der Arzt Christoph Girtanner schrieb 1795 zur Gewinnung von Ameisensäure folgenden Text: Die Ameisensäure erhält man durch Destillation aus den Ameisen (Formica rufa). Man destilliert Ameisen bei gelindem Feuer, und erhält in der Vorlage die Ameisensäure. Sie macht ungefähr die Hälfte des Gewichtes der Ameisen aus. Oder man wäscht die Ameisen in kaltem Wasser ab, legt sie nachher auf ein Tuch, und gießt kochendes Wasser darüber. Drückt man die Ameisen gelinde aus, wird die Säure stärker. Um die Säure zu reinigen, unterwirft man sie wiederholt der Destillation, und um sie zu konzentrieren, lässt man sie gefrieren. Oder noch besser: man sammelt Ameisen, preßt sie aus, ohne Wasser, und destilliert die Säure davon. Der französische Chemiker Joseph Louis Gay-Lussac synthetisierte die Ameisensäure als Erster aus dem Cyanwasserstoff. 1855 erfand ein anderer französischer Chemiker, Marcellin Berthelot, die Synthese aus Kohlenmonoxid, welche noch heute angewendet wird. Lange Zeit war Ameisensäure nur von geringer technischer Bedeutung. In den späten 60er Jahren des 20. Jahrhunderts fielen bedeutende Mengen Ameisensäure als Nebenprodukt bei der Synthese von Essigsäure an. Erst später wurde Ameisensäure in größerem Stil genutzt. Sie wurde jetzt nicht mehr nur als Nebenprodukt gewonnen, sondern gezielt synthetisch hergestellt. GewinnungDie urtümliche Isolation der Ameisensäure aus toten Ameisen wird heutzutage natürlich nicht mehr durchgeführt. Die Herstellung der Ameisensäure erfolgt in der chemischen Industrie meist nach dem von Marcellin Berthelot 1855 erfundenen Verfahren. Die Synthese gliedert sich hierbei in zwei Verfahrensschritte, bei denen giftiges Kohlenmonoxid verwendet wird:
Auch die Herstellung der Ameisensäure aus Methanol erfolgt unter anderem mit Hilfe von Kohlenmonoxid. Auch hier werden zwei Verfahrensschritte durchlaufen. Als Zwischenprodukt wird Ameisensäuremethylester hergestellt. Am Ende wird Methanol zurückgewonnen, welches wieder als Ausgangsprodukt für diese Synthese genutzt werden kann:
Weil die Hydrolyse des Ameisensäuremethylesters viel Wasser verbrauchen würde, benutzen einige Hersteller von Ameisensäure einen indirektes Verfahren mit Ammoniak, bei dem wiederum zwei Verfahrensschritte vonnöten sind. Dieses indirekte Verfahren birgt jedoch Probleme, weil teilweise das Nebenprodukt Ammoniumsulfat freigesetzt wird:
Aufgrund dieses Problems wurde von den Hersteller ein neues Verfahren der direkten Hydrolyse entwickelt, bei dem die Ameisensäure energiegünstig aus den großen Mengen von Wasser abgesondert werden kann. Ein Beispiel hierfür ist ein Verfahren der BASF, bei dem mit Hilfe einer organischen Base die Ameisensäure durch Flüssigextraktion abgesondert werden kann. Des Weiteren fällt Ameisensäure als Nebenprodukt bei der Herstellung von Essigsäure aus Leichtbenzin oder Butan an. Auch mit Hilfe von Blausäure kann Ameisensäure hergestellt werden. Für die Herstellung aus Methanol gibt es ein zweites Verfahren. Hierbei wird Methanol zu Formaldehyd und Ameisensäure umgesetzt. Diese drei Verfahren sind allerdings von geringer technischer Bedeutung. VorkommenAuf der Erde findet sich die Ameisensäure nur in Tieren und Pflanzen, in geringen Mengen auch im menschlichen Körper - allerdings nie in reiner Form. Sogar im Weltall finden sich Spuren der Ameisensäure. In der Natur ist Ameisensäure weit verbreitet. Sie wird von vielen Pflanzen- und Tierarten, besonders von Stechimmen, als Bestandteil von Giftcocktails zu Verteidigungs- beziehungsweise Angriffszwecken genutzt. Die Raupen des Großen Gabelschwanz (Cerura vinula) - einer Schmetterlingsart - sowie einige Ameisenarten (Angehörige der Unterfamilie Formicinae) verspritzen zur Verteidigung eine ameisensäurehaltige Flüssigkeit. Während die Gabelschwanzraupen die Ameisensäure nur einige Zentimeter weit verspritzen können, kommen z. B. Waldameisen bei der Verteidigung ihres Ameisenhaufens auf etwa einen Meter Reichweite. Einige Laufkäfer- sowie Bienenarten benutzen Ameisensäurecocktails sowohl zu Verteidigungs- als auch zu Angriffszwecken. Bei einigen Quallenarten ist die Ameisensäure ein Bestandteil des Giftes in den Nesseln, mit dem die Beute vergiftet wird. In den Brennhaaren der Brennnesseln befindet sich ein Nesselgift, das unter anderem Ameisensäure und Natriumformiat enthält. Im menschlichen Organismus entsteht Ameisensäure neben Formaldehyd bei der Metabolisierung von Methanol. Ameisensäure ist biologisch leicht abbaubar. In interstellarer Materie (Gas- und Staubwolken) sind etwa 3/4 der Stoffe kohlenstoffhaltige Verbindungen. Hier beobachtet man auch Spuren der Ameisensäure. Auf Kometen findet sich häufig Ameisensäure. In der Hülle (Koma) des Kometen Hale-Bopp fanden sich normalisiert auf 100 mol Wasser 0,06 mol Ameisensäure. Auch auf vielen anderen Kometen finden sich Spuren von Ameisensäure. Auf einigen weiteren Planeten wurde sie ebenfalls in geringen Spuren gefunden. SicherheitGefahren und SchutzmaßnahmenDer Kontakt mit Ameisensäure oder konzentrierten Dämpfen reizt die Atemwege und Augen. Sie führt auf der Haut ab einer Konzentration über zehn Prozent zu teils schweren Verätzungen und Blasen. Bei ihrem Zerfall kann das Atemgift Kohlenmonoxid entstehen. Deswegen sollte Vorsicht walten, wo immer größere Mengen von Ameisensäure zu finden sind. Ameisensäure kann vom Körper abgebaut werden. Sie ist schwach wassergefährdend. Bei chronischer Aussetzung kann sie zu Hautallergien führen. Tierversuche haben gezeigt, dass Ameisensäure mutagen wirkt. Außerdem führt sie zu Leber- und Nierenschäden. Ameisensäure muss an einem gut belüfteten, kühlen Ort aufbewahrt werden. Behälter, in denen Ameisensäure gelagert wird, müssen außerdem mit einer Druckausgleichverschraubung verschlossen werden, da sonst beim Zerfall durch entstehende Gase ein Überdruck entstehen kann. Bei Versuchen mit Ameisensäure müssen Schutzbrille und Handschuhe verwendet werden. Ameisensäurebehälter sollten unter Verschluss aufbewahrt und ihre Dämpfe nicht eingeatmet werden. Die maximale Arbeitsplatz-Konzentration liegt bei 5 ml/m³. Erste Hilfe und BrandbekämpfungBei Kontakt mit der Ameisensäure oder ihren Dämpfen mit den Augen müssen diese ungefähr 15 min lang mit Wasser ausgespült und ein Arzt konsultiert werden, da sie zu bleibenden Augenschäden führen kann. Auch bei Hautkontakt sollte die betroffene Stelle mit Wasser abgespült werden. Ernsthafte Schäden sind bei Hautkontakt von einigen Sekunden jedoch nicht zu erwarten. Beim Einatmen sollte sofort für Frischluftzufuhr gesorgt und beim Verschlucken viel Wasser getrunken werden, um die Säure zu verdünnen. Es dürfen allerdings kein Erbrechen herbeigeführt und keine Neutralisationversuche unternommen werden. Bei jeder Art Unfall oder Unwohlsein aufgrund von Ameisensäure sollte sofort ein Arzt hinzugezogen werden. Die beschriebenen Maßnahmen und Gefahren dieses und des oberem Abschnittes entsprechen den in Anhang 1 der RL 67/548/EWG vorgeschriebenen R- und S-Sätzen: R:35; S:(1/2-)23-26-45. Weitere ausführliche Informationen sind dort zu finden. Ab einem Volumenanteil von 12–38 Prozent in Luft bilden Dämpfe der Ameisensäure explosive Gemische. Auch bei Anwesenheit von Nickelkatalysatoren und Nitromethan besteht Explosionsgefahr. Der Flammpunkt der Ameisensäure liegt bei 69 °C, die Zündtemperatur bei 480 °C. Die Dämpfe sind schwerer als Luft und brennbar. Das Löschmittel sollte je nach Situation ausgewählt werden. Möglich sind Wassernebel, Schaum oder Kohlenstoffdioxid.
Literatur
Kategorien: Ätzender Stoff | Lesenswert | Alkansäure | Carbonsäure |
|||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Ameisensäure aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||