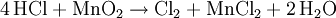Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Salzsäure
Salzsäure (systematischer Name Chlorwasserstoffsäure) ist eine wässrige Lösung des Gases Chlorwasserstoff (Summenformel HCl). Sie ist eine starke, anorganische Säure und zählt zu den Mineralsäuren. Die Salze der Chlorwasserstoffsäure heißen Chloride. Das bekannteste Chlorid ist das Natriumchlorid (NaCl, Kochsalz). Weiteres empfehlenswertes Fachwissen
GeschichteSalzsäure dürfte schon den ersten Alchemisten bekannt gewesen sein. Ihre Entdeckung wird Maria Prophetissa im 1. Jahrhundert und im 9. Jahrhundert Geber zugeschrieben. Bereits Basilius Valentinus gewann in der ersten Hälfte des 15. Jahrhunderts Salzsäure durch Reaktion von Halit (Steinsalz) mit Eisenvitriol. Die Herstellung aus Speisesalz und Schwefelsäure gelang Johann Rudolph Glauber im 17. Jahrhundert. Lavoisier nannte Salzsäure acide muriatique (lat. muria = Salzlake). Kochsalzhaltige Quellen werden heute noch als muriatische Quellen bezeichnet. In Nordamerika wird Salzsäure auch muriatic acid genannt. VorkommenIn der Natur findet sich Salzsäure in Vulkangasen und in verdünnter Lösung in Kraterseen. In freier Form kommt sie im Magensaft der Wirbeltiere vor (0,1 bis 0,5 Massenprozent). Fast unerschöpflich sind die Vorkommen an Salzen der Salzsäure, als Steinsalz und gelöst im Meerwasser. Gewinnung und DarstellungHergestellt wird Salzsäure im Labor aus konzentrierter Schwefelsäure und Kochsalz (daher der Name): Die Schwefelsäure verdrängt den Chlorwasserstoff aus seinem Salz, obwohl Chlorwasserstoff die stärkere Säure ist. Das ist möglich, weil Chlorwasserstoff gasförmig ist und sich praktisch nicht in Schwefelsäure löst. Dadurch verschwindet Chlorwasserstoff ständig aus dem Gleichgewicht. Das entstandene Sulfat ist Natriumhydrogensulfat, ein saures Salz. In der chemischen Industrie wird hochreiner Chlorwasserstoff durch die Verbrennung von Chlorknallgas (ein Gemisch aus Wasserstoff und Chlor) gewonnen. Um die Säure fertigzustellen, löst man das Chlorwasserstoffgas in Wasser: Technisch reine Salzsäure fällt hauptsächlich als Nebenprodukt bei der Chlorierung organischer Verbindungen an. Eigenschaften
HCl-Gas löst sich bei 0 °C sehr gut in Wasser (wenn Wasser noch als flüssige Phase vorliegt) (815 g beziehungsweise 507 l in einem Liter). Dabei entsteht Wärme. Bei 25 °C enthält ein Liter gesättigte Salzsäure 825 g HCl (42,7 %).[2] Die Dichte der Lösung beträgt 1,20 g·cm−3. Die Konzentrationsabhängigkeit der Dichte ist in der nebenstehenden Tabelle gezeigt. Zwischen der Dichte und dem prozentualen Gehalt an HCl besteht ein zufälliger mathematischer Zusammenhang: Die verdoppelten Nachkommastellen entsprechen der Konzentration, z. B. 1,10 g·cm−3 ist die Dichte von 20 %iger Salzsäure. Salzsäure mit Gehalten von über 36 Gewichtsprozent HCl wird auch als rauchende Salzsäure bezeichnet, da sich über offenen Gefäßen ein weißer Nebel bildet. Reine Salzsäure kann ohne Rückstände verdampft werden. Wird Salzsäure mit einem HCl-Gehalt von über 20 Gewichtsprozent erhitzt, so entweicht mehr HCl als Wasser, bis ein Gemisch von 20 % HCl und 80 % Wasser übrig bleibt, das man als Azeotrop bezeichnet. Der genaue Gehalt an HCl im Azeotrop bei 1013 mbar ist 20,17 %, der Siedepunkt liegt bei 110 °C. In Wasser dissoziiert HCl vollständig, konzentrierte Salzsäure (32 %) hat einen pH-Wert von −1. An feuchter Luft bildet HCl-Gas einen Nebel aus feinen Salzsäure-Tröpfchen. Verdünnte Salzsäure ist ein guter elektrischer Leiter. ReaktionenSalzsäure löst die meisten Metalle mit Ausnahme von Edelmetallen wie z. B. Tantal, (Germanium), Kupfer und Quecksilber (nur bei Anwesenheit von Sauerstoff) und Silber unter Bildung von Chloriden und Wasserstoff, sofern diese nicht durch Passivierung geschützt sind. Sie ist sehr gut geeignet um Stähle schnell zu entrosten, da Metalloxide mit Salzsäure zu Chloriden und Wasser reagieren: Eine Mischung von Salzsäure und Salpetersäure wird Königswasser genannt, weil sie auch Gold, den "König der Metalle", zu lösen vermag. Dazu trägt neben der oxidierenden Wirkung des Nitrosylchlorids und des nascierenden Chlors auch die Verringerung der effektiven Goldionenkonzentration durch Komplexbildung bei: VerwendungSalzsäure ist in der chemischen Industrie als anorganische Säure von großer Bedeutung. Salzsäure wird beispielsweise bei der Aufarbeitung von Erzen und Rohphosphat eingesetzt. Sie wird bei der Säurebehandlung von Erdöl- und Erdgas-Quellen verwendet sowie in der Metallverarbeitung beim Beizen, Ätzen und Löten. Salzsäure ist ein wichtiges Reagenz in der chemischen Analyse. Sie vermag eine Gruppe von Metallen durch Fällung von anderen Metallen abzutrennen. Anschließend können diese getrennt weiter analysiert werden (siehe; Salzsäuregruppe). Die Alkalimetrie ist ein weiteres Verwendungsgebiet von Salzsäure. Als Lebensmittelzusatzstoff trägt Salzsäure die Bezeichnung E 507. Biologische BedeutungBei Mensch und Tier ist die Salzsäure ein Bestandteil des Magensaftes, wo sie unter anderem die Hydrolyse von Fetten bewirkt, aber auch zum Abtöten von Keimen vor Eintritt in das weitere Verdauungssystem dient. SicherheitshinweiseKontakt mit der Haut führt zu Verätzungen. Die Dämpfe sind reizend. Bei Berührung mit den Augen sofort gründlich mit Wasser abspülen und Arzt konsultieren. Bei Unfall oder Unwohlsein sofort Arzt hinzuziehen. NachweisSalzsäure wird zum einen durch ihren Säurecharakter nachgewiesen. Ergänzend dazu identifiziert man das Chlorid-Anion in stark verdünnter Lösung durch eine Fällung mit Silbernitrat in Form von Silberchlorid: Der entstandene weiße Niederschlag löst sich in Ammoniakwasser oder in konzentrierter Salzsäure unter Komplexbildung auf: Wird Salzsäure bei Anwesenheit von Braunstein erhitzt, so entsteht Chlorgas: Der prozentuale Gehalt einer Salzsäure wird durch Titration mit Natronlauge ermittelt (→ Acidimitrie, Maßanalyse). Fotometrisch lässt sich diese Bestimmung sowie die von Chloriden mit Hilfe des Quecksilbersalzes der Chloranilsäure durchführen. Der Gehalt an Salzsäure im Magensaft bestimmt man mit Günzburgs Reagenz. Referenzen
Kategorien: Ätzender Stoff | Chemische Lösung |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Salzsäure aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






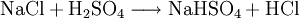
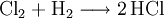
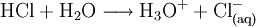
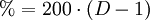
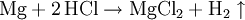
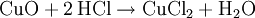
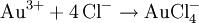

![\mathrm{AgCl + 2\,NH_3 \rightarrow [Ag(NH_3)_2]^+ + Cl^-}](images/math/4/9/1/49121ae7c77a91d5473c352e6fa0c87a.png)
![\mathrm{AgCl + HCl \rightarrow H^+ + [AgCl_2]^-}](images/math/3/a/8/3a879ff10aa188e690752f623990d547.png)