Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Nachweise für AnionenNachweise für Anionen nennt man chemische Reaktionen, mit denen ein Anion oder mehrere Anionen in einer Untersuchungssubstanz (Probe) nachgewiesen werden können. Es gibt Anionennachweise, bei denen Anionen wie Carbonat, Sulfid und Acetat direkt aus der Probe nachgewiesen werden können, und weitere Anionennachweise, die nur aus dem so genannten Sodaauszug funktionieren (für die Anionen Sulfat, Nitrat, Phosphat, Chlorid, Bromid, Iodid und Thiosulfat). Der folgende Artikel beschreibt die Durchführung dieser Anionennachweise in der qualitativ-anorganischen Analytik, wie sie an Schulen und Universitäten im Anfangsstudium gelehrt wird, und gibt die hier ablaufenden, für die allgemeine und anorganische Chemie wichtigen Reaktionen in Form von Reaktionsschemen an. Produkt-HighlightCarbonat-AnionenCarbonat-Ionen (CO32−) lassen sich durch Zugabe von Salzsäure nachweisen, bei der Kohlenstoffdioxid entsteht: Kohlenstoffdioxidgas wird in das Nachweisreagenz Kalk- oder Barytwasser geleitet. Dort erzeugt es eine weiße Trübung von Calcium- bzw. Bariumcarbonat:
Dabei ist der Störende Einfluss von Sulfit- und Thiosulfationen zu beachten, sie können durch vorheriges Zutropfen von Wasserstoffperoxidlösung entfernt werden. Halogenid-AnionenNachweis mit Silbersalzlösung und AmmoniakBeim Zutropfen von Silbernitrat-Lösung in die zu prüfende Flüssigkeit bilden sich beim Vorhandensein von Halogenid-Ionen Niederschläge. Bei Iodid-Ionen (siehe Bild Reagenzglas 1): Ausbildung eines käsig-gelben Niederschlags.
Silberiodid ist gänzlich unlöslich in Ammoniakwasser. (Reagenzglas 2) Bei Bromid-Ionen (siehe Bild Reagenzglas 3): Ausbildung eines weiß/gelblichen Niederschlags.
Silberbromid ist in konz. Ammoniakwasser etwas löslich. (Reagenzglas 4)
Bei Chlorid-Ionen (siehe Bild Reagenzglas 5): Ausbildung eines weißen Niederschlags.
Silberchlorid ist selbst in schwach konz. Ammoniakwasser recht gut löslich. (Reagenzglas 6)
Zu beachten ist dass Fluorid-Ionen, die ja auch unter die Halogenid-Ionen zählen, keinen Niederschlag mit Silbersalzlösung bilden, da Silberfluorid ein in Wasser gut lösliches Salz ist. Nachweis mit Chlorwasser und HexanEine weitere Unterscheidungsmöglichkeit ist die Zugabe von Chlorwasser und Hexan: Chlor oxidiert Bromid- und Iodidionen zum Halogen. Dieses löst sich beim Schütteln in der Hexanphase (Extraktion): Brom in Hexan sieht orangebraun aus, Iod in Hexan rosaviolett (vgl. Abb. oben, Redoxreaktion, Spannungsreihe der Nichtmetalle):
Die Oxidationszahl des Oxidationsmittels Chlor wird bei beiden Reaktionen kleiner (von 0 nach −1), es wird also reduziert, bei dem Reduktionsmittel Bromid-Ion bzw. Iodid-Ion wird die Oxidationszahl größer (von -1 nach 0), sie werden also oxidiert. Fluorid-AnionenEine kleine Portion der Probe wird in den Bleitiegel gegeben, mit gepulverter Kieselsäure oder Natriumsilicat versetzt und gemischt. Anschließend überschichtet man vorsichtig mit Schwefelsäure. Es bildet sich Siliciumtetrafluorid-Gas:
Man verschließt den Tiegel mit einer PVC-Platte, an deren Unterseite sich ein kleiner Wassertropfen befindet (dieser darf natürlich nicht in die Probe hängen) und lässt ungefähr eine Minute stehen. Das SiF4 reagiert mit dem Wasser wieder zu weißem Siliciumoxid, das sich kraterförmig im Tropfen absetzt. Eine Alternative zur PVC-Platte mit Wassertropfen ist ein schwarzes Filterpapier, das angefeuchtet wird. Das entweichende SiF4-Gas zersetzt sich dort zu SiO2, was an einem weißen Fleck erkennbar ist. Ohne Kieselgel oder Natriumsilicat kommt man aus, wenn man einen Deckel mit Öffnung verwendet, auf dem sich Glas befindet (z. B. Objektträger). Man befeuchtet die Probe im Bleitiegel mit Schwefelsäure, der entweichende Fluorwasserstoff ätzt das Glas an. Die Kriechprobe ist eine weitere Möglichkeit, Fluoride nachzuweisen. Hierzu wird eine Probe in einem Reagenzglas mit konzentrierter Schwefelsäure versetzt. Durch die entstehende Flusssäure wird das Glas angeätzt und beim Schütteln benetzt die Schwefelsäure die Wandung nicht mehr, sondern läuft tropfenförmig ab. Sulfid-AnionenSulfid-Ionen (S2−) lassen sich mit Bleiacetatpapier nachweisen, wobei eine schwarze Färbung des Papiers eintritt, hervorgerufen von Bleisulfid:
Eine weitere Möglichkeit ist das Ansäuern einer festen Probe mit einer starken Säure. Es entsteht ein abscheulich, charakteristischer Geruch nach faulen Eiern, hervorgerufen durch das Gas Schwefelwasserstoff, welches mit der Säure aus dem Sulfid verdrängt werden konnte.
Sulfat-AnionenSulfat-Ionen (SO42−) lassen sich mit salzsaurem Bariumchlorid nachweisen. Bei Zugabe einer angesäuerten Lösung von BaCl2 entsteht ein weißer Niederschlag von unlöslichem Bariumsulfat: Sulfit-AnionenSchon die Redoxreaktion mit Kaliumpermanganat als Oxidationsmittel kann einen Hinweis auf Sulfit geben (wie auch auf Eisen(II)-ionen und alle anderen Reduktionsmittel). Sulfit-Ionen (SO32−) lassen sich zum Nachweis dann per Verdrängungsreaktion mit (konzentrierter) Schwefelsäure nachweisen. Es entsteht ein stechender Geruch von Schwefeldioxid: Nitrat-AnionenNachweis über RingprobeNitrationen werden mit der Ringprobe nachgewiesen: Die Probelösung (schwefelsauer, schwermetallfrei) wird mit frischer Eisen(II)-sulfat-Lösung versetzt und mit konzentrierter Schwefelsäure überschichtet. An der Grenzfläche zwischen beiden Flüssigkeiten werden die Nitrationen zu Stickstoffmonoxid (NO) reduziert.
Dieses Radikal bildet in wässriger Lösung mit weiteren Eisenionen einen braunen Komplex, der als „Ring“ an der Phasengrenze im Reagenzglas sichtbar wird:
Der Nachweis wird durch Bromid- und Iodidionen gestört, die mit der konz. Schwefelsäure ebenfalls die Phasengrenze rotbraun färben können. Eine weitere Fehlerquelle entsteht durch Nitritionen, welche ebenfalls eine Braunfärbung hervorrufen, allerdings ist diese viel intensiver. Entfernen kann man sie durch Zugabe von Harnstoff in leicht angesäuerter Probelösung. Weitere Probleme ergeben sich bei Anwesenheit von Sulfit- und Thiosulfationen, welche die Nitrationen zu Nitritionen reduzieren und somit keine hundertprozentige Aussage über die anwesenden stickstoffhaltigen Ionen zulassen. Nachweis mittels Lunges-ReagenzEine weitere Möglichkeit ist der Nachweis mittels Lunges-Reagenz: Bei der Reaktion mit Lungereagenz muss die Lösung nitritionen-frei sein (Abtrennung siehe Ringprobe). Diese wird, wenn sie sauer ist, mit Carbonationen neutralisiert und anschließend mit Essigsäure, auf einer Tüpfelplatte, angesäuert. Danach kommen einige Tropfen Sulfanilsäure und ein Kristall β-Naphthol hinzu. Es darf an dieser Stelle keine Färbung auftreten, ansonsten ist die Probelösung nitrithaltig, was mit Zugabe von Harnstoff behoben werden muss. Nun wird noch etwas Zinkstaub hinzugegeben, welcher Nitrationen zu Nitritionen reduziert und für eine langsame gelb-orange Färbung der Lösung und eine rote Färbung des Kristalls sorgt. Der Nachweis wird durch die Anwesenheit von Nitrit-, Sulfit-, Thiosulfat- und Hexacyanoferrat(III)-Ionen gestört. Nitrit-AnionenNitrit-Ionen werden, ähnlich den Nitrat-Ionen, mittels Lunges-Reagenz nachgewiesen. Die Probelösung muss bei Untersuchung auf Nitrit-Ionen keine besonderen Eigenschaften besitzen. Sie sollte nur nicht zu sauer sein, ansonsten muss die Lösung mit Carbonat-Ionen neutralisiert werden. Nun wird die Probelösung wiederum mit stark konz. Essigsäure angesäuert. Danach kommen einige Tropfen Sulfanilsäure hinzu und ein Kristall β-Naphthol. Nimmt der Kristall an dieser Stelle eine rote Färbung an, so sind Nitrit-Ionen in der Lösung enthalten. Phosphat-AnionenPhosphate weist man mit Ammoniumheptamolybdat in salpetersaurer Lösung oder aber mit ammoniakalischer Magnesiumsalzlösung (pH 8–9) nach. Nachweis mit MolybdatlösungDie schwermetallfreie Probelösung wird mit konzentrierter Salpetersäure aufgekocht (Oxidation störender Reduktionsmittel: In Anwesendheit reduzierender Ionen wie Sulfid, Bromid, Iodid, Thiosulfat oder auch Zinn(II)-Kationen entsteht stattdessen Molybdänblau), mit Ammoniummolybdatlösung versetzt und erneut kurz aufgekocht. Dabei weist eine gelbe Trübung auf Phosphate hin, die mit Molybdaten den gelben Ammoniummolybdatophosphatkomplex bilden: Nachweis mit ammoniakalischer MagnesiumsalzlösungDie schwermetallfreie, mit Ammoniak und Ammoniumchlorid auf pH 8–9 gepufferte Probelösung wird mit Magnesiumchloridlösung versetzt. Eine weiße Trübung von Magnesiumammoniumphosphat (MgNH4PO4) zeigt ebenfalls Phosphat an (säurelöslich): Arsenat-AnionenArsenat-Nachweis mit MagnesiumsalzArsenat-Ionen ähneln dem Phosphat-Anion. Entsprechend gibt es weitere, den Phosphat-Nachweisen ähnliche Reaktionen zur Identifikation von Arsenat: Gibt man zu einer ammoniakalischen, ammoniumchloridhaltigen Lösung von Arsenat Magnesium-Ionen, so erhält man einen kristallinen Niederschlag von Magnesiumammoniumarsenat-Hexahydrat:
Arsenatnachweis mit MolybdatlösungEine weitere, dem Phosphatnachweis Nachweisreaktion von Arsenat in wässriger Lösung ist die Fällung mit Ammoniummolybdat. Der gelbe Niederschlag ist schwerlöslich in Säuren, aber gut löslich in Basen:
Thiosulfat-AnionenThiosulfat-Anionen (S2O32−) werden durch Zugabe von Silbernitratlösung im Überschuss bei pH um 7 nachgewiesen („Sonnenuntergang“): Es entsteht ein weißer Niederschlag, der sich langsam von gelb, orange über braun bis hin zum schwarzen Silbersulfid verfärbt (Reaktion in 2 Schritten – Ausfällung mit anschließender Redoxreaktion in Form einer Disproportionierung):
Cyanid-AnionenEiner Probelösung, die auf Cyanid-Ionen (CN−) zu untersuchen ist, wird folgendes beigegeben: Zuerst wird die Probelösung mit Alkalihydroxiden auf pH 8–9 gepuffert, anschließend wird Eisen(II)-sulfat-Lösung im Unterschuss zugegeben. Sind Cyanid-Ionen vorhanden, bildet sich nach dem Ansäuern (am besten mit verdünnter Schwefelsäure) das tiefblaue Pigment Berliner Blau. Doch Vorsicht: Es kann beim Ansäuern jederzeit Blausäure entweichen! Permanganat-AnionenUm Permangant-Ionen nachzuweisen, gibt es eine Reihe von Experimenten, wobei immer auf die Fähigkeit des MnO4−, Stoffe zu oxidieren, zurückgegriffen wird. Eine Reaktion, bei der man sehr schön erkennen kann, dass es sich um Permangant-Ionen handelt, ist die Oxidation von Iodid-Ionen in einer Kaliumiodid-Lösung: Der Probelösung (schwach violett bis violett, schwefelsauer) wird eine gesättigte Kaliumiodidlösung zugegeben. Eine Gelbfärbung ist erstes Anzeichen für die Oxidation der Iodid-Ionen zu elementarem Iod. Um jedoch sicher zu sein, wird etwas Stärke zu der vermeintlichen Iod-Kaliumiodid-Lösung gegeben: Eine intensive blaue bis schwarze Färbung zeigt elementares Iod an.
Thiocyanat-AnionenThiocyanat-, oder auch Rhodanid-Ionen werden qualitativ mit der „Stierblutprobe“ nachgewiesen. Dabei wird der zu untersuchenden Lösung eine gesättigte Eisen(III)-chlorid-Lösung zugegeben. Erscheint eine intensiv „stierblutrote“ Färbung, so waren Thiocyanat-Ionen vorhanden.
Borat-AnionenBorat-Ionen (BO33−) werden qualitativ über ihre Methylester nachgewiesen. Dazu wird der zu untersuchenden Lösung Methanol und einige Schwefelsäure-Tropfen als Katalysator zugegeben.
Die Dämpfe des Methanol/Trimethylborat-Gemisches werden entzündet. Es erscheint eine leuchtend grüne Flamme.
Acetat-AnionenAcetat-Ionen (CH3COO−) lassen sich mit Kaliumhydrogensulfat nachweisen, indem man das Salz, von dem man annimmt, dass es ein Acetat ist, mit Kaliumhydrogensulfat im Mörser zerreibt. Dabei wird das Proton (H+) des Hydrogensulfat-Ions auf das Acetation übertragen. Dabei entsteht Essigsäure, die leicht an ihrem typischen Geruch identifiziert werden kann.
Butyrat-AnionenButyrat-Ionen, also die Anionen der Buttersäure, lassen sich über ihren Methylester Buttersäuremethylester, oder kurz Methylbutyrat nachweisen. Dieser besitzt einen intensiven Geruch nach Apfel. Er ist einer von zwei Stoffen, die einen apfelähnlichen Geruch verbreiten. Der zweite wäre Pentylpentanoat, der sich jedoch nicht aus Methanol herstellen lässt, sodass dieses Nachweisverfahren sehr sicher für Butyrat-Ionen ist.
Eine weitere Möglichkeit, Butyrat-Ionen zu untersuchen, ist es, der Probe eine mittelstarke bis starke Säure zuzugeben. Entsteht ein ranziger Geruch nach verdorbener Butter, so waren Butyrat-Ionen in der Probe.
Tartrat-AnionenTartrat-Ionen sind die Säurerest-Ionen der Weinsäure. Sie lassen sich durch eine farbliche Komplexbildungsreaktion nachweisen. Der zu untersuchende Stoff wird, sofern dies noch nicht der Fall ist, in Wasser gelöst (siehe Bild, linkes Reagenzglas). Zu dieser wässrigen Lösung wird etwas frisch gefälltes Kupfer(II)-hydroxid gegeben, welches in neutraler Probelösung ausfällt (mittiges Reagenzglas). Anschließend wird mit Natronlauge die Lösung alkalisiert. Entsteht eine schwach dunkelblaue Lösung, so sind Tartrat-Ionen nachgewiesen. (rechtes Reagenzglas)
Siehe auchWeitere Nachweisreaktionen finden sich in den Hauptartikeln: Literatur
Kategorien: Nachweisreaktion | Analytische Chemie |
| Dieser Artikel basiert auf dem Artikel Nachweise_für_Anionen aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





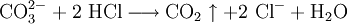
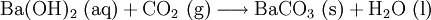
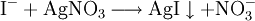
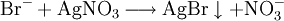
![\mathrm{AgBr + 2 \ NH_3 \longrightarrow Ag[(NH_3)_2]^+ + Br^-}](images/math/9/f/f/9ff5d7f92dbb234201146d3d3cc03abb.png)
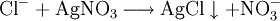
![\mathrm{AgCl + 2 \ NH_3 \longrightarrow Ag[(NH_3)_2]^+ + Cl^-}](images/math/2/2/8/22842337ea3b3a8cd481e7d10cd3a9be.png)
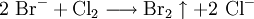
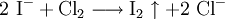
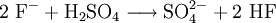
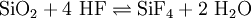
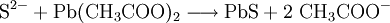
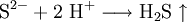
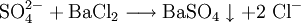
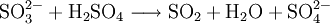
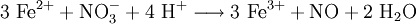
![\mathrm{Fe^{2+} + NO + 5 \ H_2O \longrightarrow [Fe(H_2O)_5NO]^{2+}}](images/math/2/7/3/2738cfe835ecbc49543586151cf3fcc0.png)
![\mathrm{H_2PO_4^- + 3 \ NH_4^+ + 12 \ MoO_4^{2-} + 22 \ H^+ + x \ H_2O \longrightarrow (NH_4)_3[P(Mo_3O_{10})_4(H_2O)_x] (gelb) + 12 \ H_2O}](images/math/7/3/1/731b3773b8ad90019a440f16a800aec0.png)
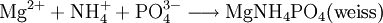
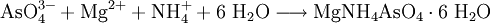
![\mathrm{H_2AsO_4^- + 22 \ H^+ + 3 \ NH_4^+ + 12 \ MoO_4^{2-} \longrightarrow (NH_4)_3[As(Mo_3O_{10})_4 \cdot aq] + 12 \ H_2O}](images/math/f/0/a/f0a4a841ce8c2fb1b3932db36de9ce96.png)
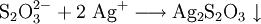
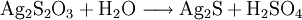
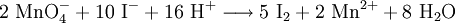
![\mathrm{n \ I_2 + -[C_6H_{10}O_5]_n- \longrightarrow -[C_6H_{10}O_5(I_2)]_n- \downarrow}](images/math/c/a/f/cafea22a34e58c29981fa68def2ffb86.png)
![\mathrm{SCN^- + Fe^{3+} + 5 \ H_2O \longrightarrow [Fe(SCN)(H_2O)_5]^{2+}_{aq}}](images/math/1/4/3/1438d41d057b5044b88a44f590016edc.png)
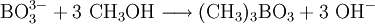
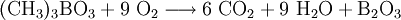
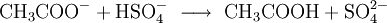
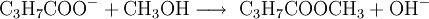
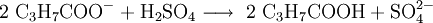
_2 + 2 \ OH^-}](images/math/d/4/1/d4139e31fbf5f09ff4df7c293bfcdb47.png)


