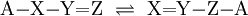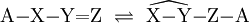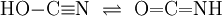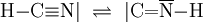Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
TautomerieDie Tautomerie (von gr. tautó = das Gleiche; gr. meros = der Anteil) bezeichnet in der Chemie eine Form der Isomerie. Sie wurde 1876 von Alexander Michailowitsch Butlerow (1828-1886) entdeckt und 1885 von Conrad Peter Laar als Begriff eingeführt. Produkt-Highlight
Einleitung
In einer reversiblen chemischen Reaktion können tautomere Isomere ineinander übergehen, indem Teile des Moleküls ihren Platz wechseln. Es liegt dann zwischen den Isomeren ein chemisches Gleichgewicht vor. Deshalb wird diese Art der Isomerie auch Gleichgewichtsisomerie genannt. Unter den normalen Bedingungen wandelt sich ein tautomerer Stoff immer von sich aus in seine Isomere, die Tautomere, und das immer in dem gleichen Mengenverhältnis. Daher der Name Tautomerie. In einigen Fällen lassen sich aus dem Gleichgewicht beide Isomere isolieren. Dies wurde früher als Desmotropie (gr. desmós = Band, Fessel; gr. tropos = Wendung) bezeichnet. Normalerweise lässt sich aus einem tautomeren Gleichgewicht nur eines der beiden Isomere isolieren, da der Entzug eines Stoffes aus einem chemischen Gleichgewicht seine Nachbildung bewirkt, wodurch das andere Isomer abgebaut wird. (Siehe Prinzip von LeChatelier) Tautomere unterscheiden sich lediglich in der Stellung einer Gruppe und in der Stellung einer Doppelbindung: Dabei sind X, Y und Z in der Regel C, N, P oder S. Als wandernde Gruppe kommen einwertige Kationen wie das Proton oder einwertige Anionen wie Chlorid-, Hydroxid- oder Acetat-Ionen in Frage. Wird eine Doppelbindung durch eine Ringbildung aus Einfachbindungen ersetzt, spricht man von der Ring-Ketten-Tautomerie. PrototropieBei der Prototropie wechselt ein Proton seinen Platz im Molekül: Keto-Enol-TautomerieDie Möglichkeit der Keto-Enol-Tautomerie besteht dann, wenn ein Aldehyd oder Keton in einer reversiblen Reaktion durch den Platzwechsel eines Protons in ein Enol umgewandelt werden kann. Durch die starke Elektronegativität des Sauerstoffatoms ist die C-O-Doppelbindung stark polarisiert. Durch ihren negativen induktiven Effekt wird auch die C-H-Bindung am α-C-Atom polarisiert, wodurch ein Proton leicht abgespalten werden kann, und ein Carbanion entsteht:
Ein Enol besitzt sowohl eine Doppelbindung (-en ist die kennzeichnende Silbe für Doppelbindungen) als auch eine Hydroxylgruppe (-ol ist die kennzeichnende Silbe für Alkohole). Durch Umlagerung des Protons der Hydroxylgruppe entsteht über das Enolat-Anion das entsprechende Aldehyd- oder Keton-Molekül. Keto- und Enolform unterscheiden sich somit durch die Position des Wasserstoffatoms und der Doppelbindung. Keto bezieht sich auf die C=O -Doppelbindung. Das Gleichgewicht liegt in der Regel auf der Seite der Ketoform. So beträgt der Anteil der Enol-Form im Aceton nur 0,00025 %. Eine Ausnahme bildet das Pentandion-(2,4) (Trivialname Acetylaceton), bei dem im Gleichgewicht die Enolform überwiegt. Beispiel: Ethanal und Ethenol befinden sich in Lösung in einem tautomeren Gleichgewicht, das Gleichgewicht liegt allerdings deutlich auf der Seite des Ethanals. Es liegt sowohl Bindungsisomerie (C=C / C=0) als auch funktionelle Isomerie (-CH=O / -C-OH) vor.
Keto-Endiol-Tautomerieα-Hydroxy-Ketone (Acyloine) weisen eine besondere Form der Keto-Enol-Tautomerie auf. 1. Das 2-Hydroxy-propanal weist am α-C-Atom (dem 2. C-Atom) eine Hydroxylgruppe auf. Diese polarisiert zusätzlich durch ihren negativen induktiven Effekt die C-H-Bindung am α-C-Atom und erleichtert damit die Abspaltung eines Protons. Es entsteht ein Endiol als ein Molekül mit einer Doppelbindung und zwei (-di-) benachbarten Hydroxylgruppen. Durch Umlagerung eines Protons kann dieses wieder in ein Molekül mit einem Carbonylsauerstoff übergehen, in diesem Fall ein Keton.
Hier liegt zusätzlich Stellungsisomerie vor, da sich das 2-Hydroxy-propanal und das 1-Hydroxypropanon nur in den Positionen der Hydroxyl- und der Carbonyl-Gruppe unterscheiden. 2. Wird im Beispiel des Propanals die Methylgruppe durch eine Kohlenwasserstoffkette mit 4 C-Atomen und je 4 Hydroxylgruppen ersetzt, liegt eine Aldohexose vor, die über die Endiol-Form mit der Ketohexose in wässriger Lösung im Gleichgewicht vorliegt. So befinden sich in wässriger Lösung die Epimere Glucose und Mannose als Aldohexosen mit der Ketohexose Fructose im Gleichgewicht. Deshalb fällt die Fehling-Probe auch bei Fructose positiv aus: Im basischen Milieu der Fehling-Lösung wandelt sie sich in Glucose oder Mannose um, die dann durch die Fehling-Lösung oxidiert werden. In der Glykolyse wird die Umwandlung von Glucose-6-Phosphat in Fructose-6-Phosphat durch das Enzym Glucose-Phosphat-Isomerase, in einem späteren Schritt der Glykolyse die Reaktion des Glycerinaldehyd-3-phosphats zu Dihydroxyacetonphosphat durch das Enzym Triose-Phosphat-Isomerase katalysiert Weitere Beispiele: Ribose und Arabinose als Aldopentosen stehen mit der Ketopentose Ribulose im tautomeren Gleichgewicht. 3. Auch die Epimerisierung, ist eine Tautomerisierung: In wässriger Lösung wandeln sich Epimere, das sind Aldosen, die sich nur durch die Stellung der Hydroxylgruppe am 2. C-Atom unterschieden, ineinander um. Beispiele für Epimeren-Paare: Glucose / Mannose, Ribose / Arabinose, Erythrose / Threose, D-Glycerinaldehyd / L-Glycerinaldehyd Siehe auch: Keto-Endiol-Tautomerie bei Phloroglucin, Reduktone. Nitro-Acinitro-TautomerieVerbindungen mit einer Nitro-Gruppe stehen in saurer Lösung mit ihrer aci-Form im Gleichgewicht. Dabei liegt das Gleichgewicht in der Regel auf der Seite der Nitroverbindung.
Nitroso-Oxim-TautomerieVerbindungen mit einer Nitroso-Gruppe stehen in saurer Lösung mit ihrer Oxim-Form im Gleichgewicht. Dabei liegt das Gleichgewicht in der Regel zu 100 % auf der Seite des Oxims.
Amin-Imin-Tautomerie
Imin-Enamin-Tautomerie
Lactam-Lactim-Tautomerie
Thiolactam-Thiolactim-Tautomerie
Ketamin-Enamin-Tautomerie
Ring-Ketten-TautomerienOxy-Cyclo-TautomerieBei langkettigen Oxo-Verbindungen könnte sich cyclo-Ether bilden. Beispiel ist die Halbacetal-Cyclo-Tautomerie. Halbacetale entstehen in einer Additions-Reaktion von Alkoholen an Carbonylverbindungen. Enthält ein Molekül eine Hydroxylgruppe, die weit genug von der Carbonyl-Gruppe entfernt ist, kann es durch eine Reaktion innerhalb des Moleküls zum Ringschluss kommen. Dabei erhält der Carbonylsauerstoff das Proton der Hydroxylgruppe und wird dadurch selbst zur Hydroxylgruppe. Der Ringschluss erfolgt durch die Bildung einer Bindung zwischen dem negativ polarisierten Sauerstoff der entfernten Hydroxylgruppe und dem positiv polarisierten Kohlenstoff der Carbonylgruppe. Zwischen der offenkettigen Aldhehyd- oder Ketoform und der Ringform liegt in wässriger Lösung ein Gleichgewicht vor. Dies ist bei allen Aldo- und Keto-Pentosen und –Hexosen in wässriger Lösung der Fall.
(vergleiche ATP und RNA, siehe auch Glucose und Fructose) Tropanol-Heptanon-TautomerieDas (1R)-1-Tropanol steht mit (R)-(Methylamino)cycloheptanon in einem tautomeren Gleichgewicht:
Anionotropie
Beispiel Butenol: 3-Hydroxy-buten-(1) steht mit 1-Hydroxy-buten-(2) in einem tautomeren Gleichgewicht, wenn es mehrere Stunden mit verdünnter Schwefelsäure auf 100 °C erhitzt wird (Gleichgewichtsverhältnis 3 : 7). Diese Tautomerie entspricht nur formal einer Anionotropie, bei welcher ein Hydroxid-Anion seine Position ändert. Der eigentliche Reaktionsmechanismus besteht darin, dass zunächst die Hydroxyl-Gruppe protoniert und anschließend als Wassermolekül abgespalten wird. Zurück bleibt ein mesomeriestabilisiertes Carbonium-Kation, welches am 1. und 3. C-Atom positiv polarisiert ist. An einem der beiden C-Atome kann sich ein Wassermolekül binden, welches durch Abspaltung eines Protons wieder zur Hydroxylgruppe wird.
Dyadische TautomerieBei der dyadischen Tautomerie (von gr. dyas = Zweiheit) findet eine Protonenwanderung zwischen Nachbaratomen statt.
Kategorien: Chemische Reaktion | Chemische Bindung |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Tautomerie aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||