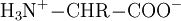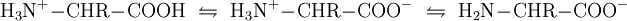Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
AminosäurenAminosäuren, genauer Aminocarbonsäuren, sind eine Klasse kleiner organischer Verbindungen mit mindestens einer Carboxylgruppe (–COOH) und mindestens einer Aminogruppe (–NH2). Der Begriff Aminosäure (veraltet Amidosäure) wird häufig vereinfachend als Synonym für die proteinogenen Aminosäuren verwendet, die die Bausteine der Proteine sind. Von den proteinogenen Aminosäuren sind bisher 23 bekannt. Das Spektrum der Klasse der Aminosäuren geht aber weit über diese hinaus. So sind bisher 250 nicht-proteinogene Aminosäuren bekannt, die biologische Funktionen haben (Stand: Februar 2006). Die Anzahl der synthetisch erzeugten und die der theoretisch möglichen Aminosäuren ist noch erheblich größer. Chemisch sind Aminosäuren primäre Amine der Carbonsäuren, daher ihre Bezeichnung. Die Stellung der Aminogruppe relativ zur Carboxylgruppe teilt die Klasse der Aminosäuren in Gruppen auf. Produkt-Highlight
Allgemeiner Aufbau der AminosäurenCarbaminsäure ist die einfachste Aminosäure. Sie enthält nur die Carboxyl- und die Aminogruppe. Alle weiteren Aminosäuren haben weitere Kohlenstoffatome am Carboxyl-Kohlenstoff. Dabei entscheidet das Kohlenstoffatom, an dem sich die Aminogruppe befindet, um was für eine Klasse von Aminosäuren es sich handelt. Sind im Molekül mehrere Aminogruppen vertreten, so bestimmt dasjenige Kohlenstoff, dessen Aminogruppe dem Carboxyl-Kohlenstoff am nächsten ist, um welche Klasse von Aminosäuren es sich handelt.
Die Bezeichnung weiterer Klassen der Aminosäuren ergibt sich nach dem gleichen Schema. Die Aminosäuren einer Klasse unterscheiden sich durch ihre Seitenkette, die auch Aminosäurerest oder kurz Rest (bzw. R) genannt wird. Ist der Rest R verschieden von den anderen Substituenten, die sich am Kohlenstoff mit der Amino-Gruppe befinden, so ist dieses Kohlenstoffatom chiral und es existieren von der entsprechenden Aminosäure zwei Enantiomere. Enthält der Aminosäurerest weitere chirale Kohlenstoffatome, so ergeben sich auch Diastereomere und die Zahl möglicher Enantiomere nimmt zu bei der entsprechenden Aminosäure. Säure- und Base-VerhaltenIn wässriger Lösung liegen Aminosäuren als Zwitterionen vor, d. h. die Aminogruppe ist protoniert und die Carboxylgruppe ist deprotoniert. Verallgemeinert lässt sich dies folgendermaßen darstellen: Dabei wirkt die Aminogruppe als Base, da sie ein Proton aufnimmt (Protonenakzeptor). Die Carboxylgruppe wirkt als Säure, da sie ein Proton abgibt (Protonendonator). Die Titration der Aminosäuren sieht grundlegend folgendermaßen aus: Ist der Aminosäurerest R ebenfalls titrierbar, so muss er in der Gleichung mit berücksichtigt werden. Die Nettoladung der Aminosäure hängt also vom pH-Wert ab, wobei die Nettoladung bei einem bestimmten pH-Wert gleich null wird. Der entsprechende pH-Wert wird als isoelektrischer Punkt bzw. als pI der Aminosäure bezeichnet. Proteinogene AminosäurenAls proteinogene Aminosäuren werden alle Aminocarbonsäuren bezeichnet, die die Bausteine der Proteine von Lebewesen sind. Dabei handelt es sich bei den proteinogenen Aminosäuren stets um α-Aminocarbonsäuren. Bis auf die Aminosäure Glycin ist für alle proteinogenen Aminosäuren das α-Kohlenstoffatom chiral (siehe auch asymmetrisches Kohlenstoffatom): Es existieren von jeder dieser Aminosäuren zwei Enantiomere. Dabei ist nur eines der beiden Enatiomere proteinogen und zwar die L-Aminosäure: der zum Aufbau der Proteine notwendige Apparat – das Ribosom, die tRNA, die Aminoacyl-tRNA Synthetase (diese belädt die tRNA mit Aminosäuren) und andere – sind selbst auch chiral und können nur die L-Variante erkennen. D-Aminosäuren kommen in Lebewesen vereinzelt vor. Sie werden dann aber unabhängig vom proteinogenen Stoffwechsel synthetisiert und bleiben daher nichtproteinogen. Sie werden z. B. in der bakteriellen Zellwand und kurzen bakteriellen Peptiden wie Valinomycin (siehe Carrier) eingebaut. Kanonische Aminosäuren20 der proteinogenen Aminosäuren werden durch Codons des genetischen Materials kodiert. Sie werden daher als kanonische Aminosäuren oder auch als Standardaminosäuren bezeichnet. Die kanonische Aminosäure Prolin besitzt, im Gegensatz zu den anderen kanonischen Aminosäuren, keine primäre, sondern eine sekundäre Aminogruppe, und wird daher auch als sekundäre Aminosäure, fälschlicherweise bzw. veraltet oft auch als Iminosäure, bezeichnet.
Nicht-kanonische AminosäurenZu den nicht-kanonischen Aminosäuren gehören alle anderen proteinogenen Aminosäuren. Diese wiederum können in drei Klassen eingeteilt werden:
Der Mensch selbst nutzt die 20 kanonischen Aminosäuren sowie Selenocystein. Von den 20 kanonischen Aminosäuren werden 12 vom menschlichen Organismus bzw. durch im menschlichen Verdauungstrakt lebende Mikroorganismen synthetisiert. Die restlichen 8 Aminosäuren sind für den Menschen essenziell, d. h. er muss sie über die Nahrung aufnehmen. Biochemische BedeutungAminosäuren als Bausteine in vielfältigen FunktionenAminosäuren sind in der Biochemie von großer Bedeutung, da sie die Bausteine von Peptiden und Proteinen (Eiweißen) sind. Im Allgemeinen werden in der Literatur zwanzig so genannte proteinogene Aminosäuren genannt, d. h. solche, die im Genom für Proteine kodiert sind, allerdings sind in letzter Zeit zwei weitere (Selenocystein und Pyrrolysin) hinzugekommen. Bei diesen handelt es sich stets um α-Aminosäuren, da die Aminogruppe und die Carboxylgruppe mit demselben Kohlenstoffatom (Cα) verbunden sind. Diese 20 Aminosäuren werden durch je drei Basen in der DNA kodiert. Darüber hinaus gibt es noch weitere Aminosäuren, die Bestandteile von Proteinen sind, jedoch nicht kodiert werden. Aminosäureketten werden in Abhängigkeit von ihrer Länge als Peptide oder Proteine bezeichnet. Bis zu einer Verkettung von etwa 50 Aminosäuren spricht man in der Regel von Peptiden. Die einzelnen Aminosäuren sind dabei innerhalb der Kette über die so genannte Peptidbindung (Säureamid) verknüpft. Ein automatisiertes Verfahren zur Synthese von Peptiden liefert die Merrifield-Synthese. In Form von Nahrung aufgenommene Proteine werden bei der Verdauung in Aminosäuren zerlegt. In der Leber werden sie weiter verwertet. Entweder werden sie zur Proteinbiosynthese verwendet oder abgebaut (siehe auch: Aminosäureindex). Die wichtigsten Mechanismen des Aminosäurenabbaus sind: Essentielle AminosäurenAminosäuren, die ein Organismus nicht selbst herstellen kann, heißen essentielle Aminosäuren und müssen mit der Nahrung aufgenommen werden. Für Menschen sind Valin, Methionin, Leucin, Isoleucin, Phenylalanin, Tryptophan, Threonin und Lysin essentielle Aminosäuren. Semi-essentielle Aminosäuren müssen nur in bestimmten Situationen mit der Nahrung aufgenommen werden, z. B. während des Wachstums oder bei schweren Verletzungen. Die übrigen Aminosäuren werden entweder direkt synthetisiert oder aus anderen Aminosäuren durch Modifikation gewonnen. Methionin kann zu einem Großteil aus Cystein synthetisiert werden. Für Kinder ist zusätzlich zu den generell essentiellen Aminosäuren Tyrosin essentiell, da in diesem Lebensalter die Körperfunktion zu dessen Herstellung noch nicht ausgereift ist. Es gibt auch Erkrankungen, die den Aminosäurestoffwechsel beeinträchtigen, dann müssen unter Umständen eigentlich nicht-essentielle Aminosäuren dennoch mit der Nahrung aufgenommen werden. Hühnereier z.B. enthalten alle essentiellen bzw. semi-essentiellen Aminosäuren, die der menschliche Körper benötigt.
Chemisch-Physikalische EigenschaftenDie proteinogenen Aminosäuren lassen sich nach ihren Resten in Gruppen aufgeteilt (siehe Tabellenübersicht der Eigenschaften). Dabei kann eine Aminosäure in verschiedenen Gruppen gleichzeitig auftauchen. In einem Mengendiagramm lassen sich die Überlappungen der Gruppen grafisch darstellen. Säure- und Basen-VerhaltenFür das Säure-Base-Verhalten proteinogener Aminosäuren ist vor allem das Verhalten des Aminosäurerestes R interessant. Das liegt daran, dass für die Biochemie vor allem Proteine interessant sind. In Proteinen sind aber die NH2- und COOH-Gruppen wegen der Peptidbindung nicht titrierbar und damit ungeladen. Die Ausnahme ist der N- und der C-Terminus des Proteins. Daher ist für das Säure-Base-Verhalten von Proteinen und Peptiden der Aminosäurerest R so wichtig.
Das Verhalten der Seitenkette R hängt von ihrer Konstitution ab, d. h., ob die Seitenkette selbst wieder als Protonenakzeptor oder -donator wirken kann. Dazu werden die proteinogenen Aminosäuren in basische und saure Aminosäuren eingeteilt. Zu den basischen Aminosäuren gehören: Zu den sauren Aminosäuren gehören:
Weitere Aminosäuren mit ionisierbaren Resten:
Die Reste R der hier genannten Aminosäuren werden auch als titrierbare Reste bezeichnet. Die Reste R der anderen proteinogenen Aminosäuren sind unter physiologischen Bedingungen nicht ionisierbar und wirken daher weder als Base noch als Säure. Der Seitenrest von Cystein wirkt zwar auch als schwache Säure, Cystein wird aber nicht zu den sauren Aminosäuren dazu gezählt, da sie unter physiologischen Bedingungen als Base (d. h. protoniert) vorliegt. Das gleiche gilt für Tyrosin. Der pK-Wert ist der pH-Wert, bei der die titrierbaren Gruppen zu gleichen Teilen protoniert und deprotoniert vorliegen. D. h., die titrierbare Gruppe liegt zu gleichen Teilen in ihrer basischen, wie in ihrer sauren Form vor (siehe auch: Henderson-Hasselbalch-Gleichung). Es ist meist üblich statt vom pKS vom pK zu sprechen, d. h. vom pK der Säure. In diesem Sinne müsste allerdings vom pK des Lysins als pKB, d.h. vom pK der Base gesprochen werden. Aus Gründen der Vereinfachung wird diese Notation aber allgemein weggelassen, da sie sich auch aus dem Sinnzusammenhang selbst ergibt (d. h. ob die Gruppe als Base oder Säure wirkt). Der pK ist keine Konstante, sondern hängt von der Temperatur, der Ionenstärke und der unmittelbaren Umgebung der titrierbaren Gruppe ab und kann daher stark schwanken. Ist der pH höher als der pK einer titrierbaren Gruppe, so liegt die tirierbare Gruppe in ihrer basichen (deprotonierten) Form vor. Ist der pH niedriger als der pK der titrierbaren Gruppe, so liegt die titrierbare Gruppe in ihrer sauren (protonierten) Form vor:
Die Seitenketten basischer Aminosäuren sind in ihrer protonierten (sauren) Form einfach positiv geladen und in ihrer deprotonierten (basichen) Form ungeladen. Die Seitenketten der sauren Aminosäuren (einschließlich Cystein und Tyrosin) sind in ihrer protonierten (sauren) Form ungeladen und in ihrer deprotonierten (basischen) Form einfach negativ geladen. Deswegen spielt der pH-Wert für die Eigenschaften der Seitenkette eine so wichtige Rolle, da das Verhalten der Seitenkette ein ganz anderes ist, wenn sie geladen bzw. ungeladen ist. Die titrierbaren Seitenketten beeinflussen zum Beispiel das Löslichkeitsverhalten der entsprechenden Aminosäure. In polaren Lösungsmitteln gilt: geladenene Seitenketten machen die Aminosäure löslicher, ungeladene Seitenketten machen die Aminosäure unlöslicher. In Proteinen kann das dazu führen, das bestimmte Abschnitte hydrophiler oder hydrophober werden, wodurch die Faltung und damit die Aktivität von Enzymen vom pH-Wert abhängt. Mit stark sauren und basischen Lösungen können Proteine deswegen auch denaturiert werden.
* Thiolgruppe Tabellenübersicht der Eigenschaften
Nicht-proteinogene AminosäurenVon den nicht-proteinogenen, d. h. nicht in Proteinen vorkommenden, Aminosäuren sind bislang über 250 bekannt, die in Organismen vorkommen. Dazu gehört etwa das Thyroxin, ein Hormon der Schilddrüse, L-DOPA, Ornithin oder das in fast allen Arten von Cyanobakterien nachgewiesene Neurotoxin Beta-Methylamino-Alanin (BMAA). Die meisten nicht-proteinogenen Aminosäuren leiten sich von den proteinogenen ab, die L-α-Aminosäuren sind. Dennoch können dabei auch β-Aminosäuren (β-Alanin) oder γ-Aminosäuren entstehen (GABA). Zu den nicht-proteinogenen Aminosäuren zählen auch alle „rechtsdrehenden“ D-Varianten der proteinogenen Aminosäuren. Zu den synthetischen Aminosäuren gehört das APV, ein Antagonist des NMDA-Rezeptors, oder der Süßstoff Aspartam.
AminosäurestoffwechselBiosynthese der proteinogenen L-AminosäurenAlanin wird aus Pyruvat gebildet. Glycin und Serin können aus 3-Phosphoglycerat, einem Intermediat der Glycolyse synthetisiert werden. Glutamat wird aus α-Ketoglutarat (Citratzyklus) gebildet. Aus Glutamat kann dann Prolin, Arginin und Glutamin produziert werden. Aus Oxalacetat (Citratzyklus) können Aspartat und Asparagin hergestellt werden. Cystein entsteht beim Abbau der schwefelhaltigen essentiellen Aminosäure Methionin. Tyrosin wird aus der essentiellen Aminosäure Phenylalanin generiert. Essentielle Aminosäuren können vom Körper nicht gebildet werden, weil sie entweder aromatisch (Phenylalanin, Histidin, Tryptophan) oder verzweigt (Valin, Leucin, Isoleucin) sind. Abbau der proteinogenen L-AminosäurenDie proteinogenen Aminosäuren werden auf vielfältige Weise abgebaut. Sie können zu Vorstufen für die Gluconeogenese abgebaut werden und sind somit glucogen. Werden sie zu Vorstufen der Ketonkörper-Synthese abgebaut so sind die ketogen. In den meisten Fällen steht am Anfang des Aminosäurenabbaus die Abspaltung der Aminogruppe durch Transaminierung. Der Stickstoff wird über Glutamat und Aspartat in den Harnstoffzyklus eingeschleust und als Harnstoff oder direkt als Ammoniak über die Niere ausgeschieden.
Schema des Aminosäurestoffwechsels
Peptid-BindungAminosäuren bilden miteinander unter Abspaltung von Wasser Peptid-Bindungen. Dafür werden die Aminosäuren am Ribosom zu einer langen Peptid-Kette verknüpft. Die Peptidbindung zwischen zwei Aminosäuren entsteht, indem die Amino-Gruppe der einen Aminosäure mit der Carboxyl-Gruppe der nächsten Aminosäure unter Wasserabspaltung reagiert. Quellen
Literatur
Kategorien: Aminosäure | Stoffgruppe |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Aminosäuren aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |