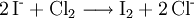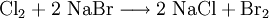Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Halogene
Als Halogene [haloˈɡeːnə] („Salzbildner“, von agr. ἅλς hals, „Salz“ und γεννάω gennáō, „erzeugen“) bezeichnet man die Elemente der 7. Hauptgruppe (17. Gruppe) des chemischen Periodensystems. Die Halogene im einzelnen sind Fluor, Chlor, Brom und Iod, sowie das aufgrund seiner Radioaktivität äußerst seltene und weitgehend unerforschte Element Astat. Die erstgenannten vier stabilen Elemente spielen eine wichtige Rolle in Chemie und Biologie. Astat findet aufgrund seiner Radioaktivität und Seltenheit keine Verwendung. Die Elemente der nächsten Nachbargruppen sind die Chalkogene und die Edelgase. Produkt-Highlight
EigenschaftenElementare Halogene liegen in Form von zweiatomigen Molekülen der Form X2 vor, wie beispielsweise F2 und Cl2. Weil ihnen nur noch ein einziges Valenzelektron zur Vollbesetzung der Valenzschale fehlt, sind alle Halogene im atomaren Zustand sehr reaktionsfreudig. Da die Halogen-Halogen-Bindung nicht sehr stabil ist, reagieren auch Halogenmoleküle heftig; die Reaktivität nimmt, wie die Elektronegativität, von Fluor zu Iod ab. Gleichzeitig steigt die 1. Ionisierungsenergie nach oben hin an. Die Eigenschaften von Astat sind größtenteils unerforscht, wahrscheinlich ist es aber aus chemischer Sicht dem Iod sehr ähnlich. Charakteristische Reaktionen
Verbindungen
Halogenwasserstoffesiehe auch Hauptartikel: Halogenwasserstoffe
Sauerstoffsäuren der HalogeneMit Ausnahme von Fluor, dessen einzige Sauerstoffsäure die instabile Hypofluorige Säure ist, bilden die Halogene vier Arten von Sauerstoffsäuren, die wie folgt benannt werden:
Die Säurestärke wächst mit steigender Zahl der Sauerstoffatome, ebenso die oxidierende Wirkung. Die meisten Sauerstoffsäuren der Halogene sind sehr instabil und zersetzen sich exotherm. Interhalogenverbindungensiehe auch Hauptartikel: Interhalogenverbindungen Interhalogenverbindungen sind Verbindungen der Halogene untereinander. Es gibt folgende Arten:
Interhalogenverbindungen sind bei Standardbedingungen instabil oder äußerst reaktiv. Es existieren auch Interhalogenidionen wie beispielsweise BrF6- und IF6-. VorkommenHalogene kommen in der Natur vor allem als einfach negativ geladene Anionen in Salzen vor. Das zugehörige Kation ist meist ein Alkali- oder Erdalkalimetall, insbesondere die Natriumsalze der Halogene sind häufig anzutreffen. Aus diesen können dann die Halogene mittels Elektrolyse gewonnen werden. Ein nicht unbeträchtlicher Teil der Halogenide ist im Meerwasser gelöst. Wichtige Halogenid-Verbindungen:
Im Gegensatz zu den anderen Halogenen kommt Iod auch in der Natur als Iodat vor. Astat, das seltenste natürlich vorkommende Element, ist Zwischenprodukt der Uran- und Thoriumzerfallsreihe. Die Gesamtmenge in der Erdkruste beträgt gerade einmal 25 Gramm. Gewinnung der ReinelementeFluorgas F2 lässt sich nur durch elektrochemische Vorgänge gewinnen, da es kein Element und keine Verbindung gibt, die ein größeres Redox-Potential als Fluor hat und dieses oxidieren könnte (Oxidation, weil Elektronenabgabe von 2 F- zu F2, andere Halogene dito).
Hier sei zur Gewinnung von Chlor auch das Deacon-Verfahren erwähnt (Oxidation von Salzsäuregas zu Wasser und Chlorgas):
NachweisNachweis mit Silbernitrat und AmmoniakBei Zugabe von Silber(I)nitrat-Lösung zur zu prüfenden Flüssigkeit bildet sich beim Vorhandensein von Halogenid-Ionen ein charakteristisch gefärbter Niederschlag des Silberhalogenids. So beispielsweise bei einer Kochsalzlösung:
Alle Silberhalogenide zersetzen sich unter Lichteinwirkung. Nachweis mit Chlorwasser und Hexan
Eine weitere Unterscheidungsmöglichkeit für Brom und Iod ist die Zugabe von Chlorwasser und Hexan, wobei die Halogenidionen zum Halogen oxidiert werden. Dieses löst sich beim Schütteln in der Hexanphase (Extraktion) und kann dort einfach aufgrund der Färbung identifiziert werden:
Elementares Chlor setzt bei dieser Redoxreaktion aus Natriumbromid (NaBr) elementares Brom frei und es bildet sich Natriumchlorid, wobei das Chlor selbst reduziert und das Brom oxidiert wird.
Siehe auch
Kategorien: Stoffgruppe | Halogen |
|||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Halogene aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||




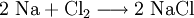
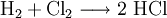
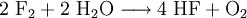
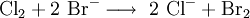
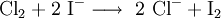
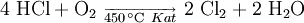
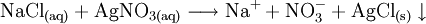
![\mathrm{Ag^+} + 2\ \mathrm{NH_3} \longrightarrow \mathrm{[Ag(NH_3)_2]^+}](images/math/8/1/7/81791c809b22bdb48ed9bbfd6ebdae2d.png)