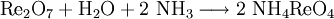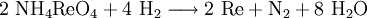Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Rhenium
Rhenium ist ein chemisches Element mit dem Symbol Re und der Ordnungszahl 75. Im Periodensystem der Elemente steht es in der 7. Gruppe oder Mangangruppe. Es ist ein seltenes, silberweiß glänzendes, schweres Übergangsmetall. Verwendung findet es vor als Legierungsbestandteil, in Thermoelementen und als Katalysator in der Benzinherstellung. Biologische Funktionen sind nicht bekannt, es kommt normalerweise nicht im menschlichen Organismus vor und ist nicht toxisch. Produkt-Highlight
GeschichteDie Existenz des späteren Rheniums wurde erstmals 1871[2] von Dmitri Iwanowitsch Mendelejew als Dwi-Mangan vorhergesagt. Er schloss aus den Gesetzmäßigkeiten des von ihm entworfenem Periodensystems, dass unterhalb des Mangans zwei noch unbekannte Elemente, die späteren Technetium und Rhenium, stehen müssten. Entdeckt wurde Rhenium erst 1925 von Walter Noddack, Ida Tacke und Otto Berg. Sie untersuchten Columbit um die gesuchten Elemente Eka- und Dwi-Mangan zu finden. Da die gesuchten Elemente darin nur in sehr geringem Maßstab enthalten sind, mussten sie durch Abtrennen der anderen angereichert werden. Schließlich konnte das spätere Rhenium durch Röntgenspektroskopie nachgewiesen werden.[3] Noddack und Tacke behaupteten auch, sehr geringe Mengen des späteren Technetiums gefunden zu haben, jedoch konnte dies nicht durch Darstellung des Elementes bestätigt werden. Sie nannten die Elemente nach ihren Heimatgegenden Rhenium (lat. Rhenus für Rhein) und Masurium (von Masuren). Dieser Name setze sich jedoch nach der entgültigen Entdeckung des Technetiums 1937 nicht durch. 1928 konnten Noddack und Tacke erstmals ein Gramm Rhenium aus 660 Kilogramm Molybdänerz extrahieren.[4] Wegen der hohen Kosten begann die Herstellung nennenswerter Mengen erst ab 1950, als man für entwickelte Wolfram-Rhenium- und Molybdän-Rhenium-Legierungen einen größeren Bedarf hatte. VorkommenRhenium zählt mit Rhodium, Ruthenium und Osmium zu den seltensten stabilen Elementen auf der Erde. Sein Anteil an der Erdkruste beträgt nur 0,4 ppb[5]. Es kommt nicht gediegen, sondern ausschließlich gebunden in einigen Erzen vor. Da Rhenium ähnliche Eigenschaften wie Molybdän besitzt, findet man es vor allem in Molybdänerzen wie Molybdänglanz MoS2. In ihnen kann bis zu 0,2 %[6] Rhenium enthalten sein. Weitere rheniumhaltige Minerale sind Columbit (Fe, Mn)[NbO3], Gadolinit Y2 Fe Be [O|SiO4]2 und Alvit ZrSiO4. Wichtigen Vorkommen liegen in den Vereinigten Staaten, Kanada und Chile. Auch im Mansfelder Kupferschiefer ist in geringen Mengen Rhenium enthalten. Bisher wurde erst ein Rheniummineral, das Rheniit (Rhenium(IV)-sulfid, ReS2) entdeckt. Der Fundort lag in am Gipfelkrater des Vulkans Kudriavy auf der Insel Iturup der Kurilen (Russland).[7] Gewinnung und DarstellungDer Grundstoff für die Gewinnung von Rhenium sind Molybdänerze, insbesondere Molybdänglanz. Werden diese im Zuge der Molybdängewinnung geröstet, reichert sich Rhenium als flüchtiges Rhenium(VII)-oxid im Flugstaub an. Wird das angereicherte Rhenium(VII)-oxid mit ammoniakhaltigem Wasser umgesetzt entsteht Ammoniumperrhenat (NH4ReO4). Dieses wird bei hohen Temperaturen mit Wasserstoff zu elementarem Rhenium reduziert. Die Hauptproduzenten waren 2006 Chile, Kasachstan und die Vereinigten Staaten, die Gesamtmenge an produziertem Rhenium belief sich auf etwa 45 Tonnen.[8] EigenschaftenPhysikalische EigenschaftenRhenium ist ein weißglänzendes hartes Schwermetall, das ähnlich Palladium und Platin aussieht. Es kristallisiert in einer hexagonal-dichtesten Kugelpackung. Die Dichte des Rheniums 21,03 g/cm3[10] wird nur von den drei Platinmetallen Osmium, Iridium und Platin übertroffen. Rhenium zählt zu den Elementen mit den höchsten Schmelzpunkten. Mit 3186 °C[11] wird er nur noch von dem höchstschmelzenden Metall Wolfram (3387 °C[11]) und Kohlenstoff. Rhenium lässt sich gut durch Schmieden und Verschweißen verarbeiten, da es duktil ist und dies im Gegensatz zu Wolfram oder Molybdän auch nach Rekristallisation bleibt. Beim Schweißen von Rhenium tritt auch keine Versprödung auf, die zu einer höheren Sprödigkeit und damit schlechteren Materialeigenschaften führen würde.[12] Chemische VerbindungenObwohl Rhenium mit einem negativen Standardpotential nicht zu den Edelmetallen zählt, ist bei Raumtemperatur unreaktiv und gegenüber Luft stabil. Erst beim Erhitzen reagiert es ab 400 °C[10] mit Sauerstoff zu Rhenium(VII)-oxid. Auch mit den Nichtmetallen Fluor, Chlor und Schwefel reagiert es beim Erhitzen. In nichtoxidierenden Säuren, wie Salzsäure oder Flusssäure ist Rhenium nicht löslich. Dagegegen lösen die oxidierenden Schwefel- und Salpetersäure leicht Rhenium. Mit Oxidationsschmelzen bilden sich leicht Rhenate der Form RhO4-. IsotopeEs sind insgesamt 34 Isotope und weiter 20 Kernisomere des Rheniums bekannt.[13] Von diesen kommen zwei, die Isotope 185Re und 187Re natürlich vor. 185Re, das mit einem Anteil von 37,40 %[13] an der natürlichen Isotopenverteilung vorkommt, ist das einzige stabile Isotop. Das mit einem Anteil 62,60 %[13] häufigere 187Re ist schwach radioaktiv. Es zerfällt unter Betazerfall mit einer Halbwertszeit von 4,12 · 1010[13] Jahren zu 187Os. Beide Isotope sind mit Hilfe der Kernspinresonanzspektroskopie nachweisbar. Von den künstlichen Isotopen werden 186Re und 188Re als Tracer verwendet. 188Re dient als radioaktives Arzneimittel in der Tumortherapie[14] Siehe auch: Liste der Rhenium-Isotope VerwendungRhenium wird meist nicht elementar verwendet, sondern als Beimischung in einer Vielzahl von Legierungen eingesetzt. Etwa 70 %[15] des Rheniums wird als Zusatz in Nickel-Superlegierungen genutzt. Ein Zusatz von bis zu 4–6 % Rhenium bewirkt eine Verbeserung des Kriech- und Ermüdungsverhaltens bei hohen Temperaturen. Diese Legierungen werden als Turbinenschaufeln für Flugzeugtriebwerke eingesetzt.[16] Weitere 20 % der produzierten Rheniummenge wird für Platin-Rhenium-Katalysatoren verwendet. Diese spielen eine große Rolle bei der Herstellung von bleifreiem Benzin mit hohen Oktanzahlen. Der Vorteil des Rheniums liegt darin, dass es im Vergleich mit reinem Platin nicht so schnell durch Verkohlung vergiftet wird. Dadurch ist es möglich die Produktion bei niedrigeren Temperaturen und Drücken durchzuführen und so wirtschaftlicher zu produzieren. Auch andere Kohlenwasserstoffe, wie Benzol, Toluol und Xylol lassen sich mit Platin-Rhenium-Katalysatoren herstellen.[15] Thermoelemente für die Temperaturmessung bei hohen Temperaturen (bis 2200 °C[17]) werden aus Platin-Rhenium-Legierungen gefertigt. Auch als Legierung mit anderen Metallen, wie Eisen, Cobalt, Wolfram, Molybdän oder Edelmetallen verbessert Rhenium die Beständigkeit gegenüber Hitze und chemischen Einflüssen. Die Anwendung ist jedoch durch die Seltenheit und den hohen Preis des Rheniums beschränkt. In einigen Spezialanwendungen wird ebenfalls Rhenium verwendet. Dies sind beispielsweise Glühkathoden in Massenspektrometern oder Kontakte in elektrischen Schaltern. NachweisEs gibt mehrere Möglichkeiten, Rhenium nachzuweisen. Eine Möglichkeit sind spektroskopische Methoden. Rhenium besitzt eine fahlgrüne Flammenfärbung mit charakteristischen Spektrallinien bei 346 und 488,9 nm.[18] Gravimetrisch ist Rhenium über die charakteristisch kristallisierende Perrheniumsäure oder verschiedene Perrhenat-Salze, etwas Tetraphenylarsonium-perrhenat nachweisbar.[19] Auch moderne analytische Methoden wie Massenspektrometrie oder Kernresonanzspektroskopie sind für den Nachweis des Elementes geeignet. SicherheitshinweiseWie viele Metalle ist Rhenium in Pulverform leichtentzündlich und brennbar. Zum Löschen darf wegen des entstehenden Wasserstoffes kein Wasser verwendet werden. Stattdessen sind als Löschmittel Löschpulver oder Metallbrandlöscher zu verwenden.[1] Kompaktes Rhenium ist dagegen nicht brennbar und ungefährlich. Rhenium hat keine bekannte biologische Bedeutung für den menschlichen Organismus. Über die Toxizität von Rhenium ist nichts genaueres bekannt, es existieren keine Toxizitätswerte. Rhenium gilt arbeitshygienisch aber als unbedenklich.[10] VerbindungenRhenium bildet eine große Zahl an Verbindungen, wie bei Mangan und Technetium sind Verbindungen in den Oxidationsstufen von -III bis +VII bekannt. Im Gegensatz zu Mangan sind jedoch Verbindungen in den hohen Oxidationsstufen beständiger als in den niedrigeren. OxideEs sind insgesamt fünf Oxide des Rheniums, Re2O7, ReO3, Re2O5, ReO2 und Re2O3 bekannt. Rhenium(VII)-oxid Re2O7 ist das stabilste Rheniumoxid. Es ist ein Zwischenprodukt bei der Rheniumgewinnung und kann als Ausgangsverbindung für die Synthese des Katalysators Methyltrioxorhenium (MTO) genutzt werden.[20] In Wasser löst es sich unter Bildung der stabilen Perrheniumsäure HReO4. Rhenium(VI)-oxid ReO3 hat eine charakeristische Kristallstruktur, die als Kristallstrukturtyp (Rheniumtrioxid-Typ) dient.
Literatur
Einzelnachweise
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Rhenium aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||