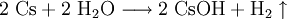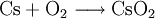Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Caesium
Caesium (Schreibweise nach IUPAC auch Cesium), umgangssprachlich auch Cäsium oder Zäsium, ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol Cs und der Ordnungszahl 55. Das extrem reaktive, goldfarbene, in hochreinem Zustand silbrig glänzende Alkalimetall schmilzt bei Körpertemperatur. Produkt-Highlight
GeschichteCaesium wurde erstmals 1860 zusammen mit Rubidium von dem deutschen Chemiker Robert Wilhelm Bunsen und dem deutschen Physiker Gustav Robert Kirchhoff, den Erfindern der Spektralanalyse, im Dürkheimer Mineralwasser nachgewiesen. Der Name Caesium ist vom lateinischen caesius abgeleitet, was „himmelblau“ bedeutet. Der Name nimmt Bezug auf die typischen Spektrallinien des Caesiums, welche im blauen Bereich liegen, und wurde 1861 von Bunsen/Kirchhoff vergeben. Im Jahr 1882 stellte Carl Setterberg erstmals metallisches Caesium durch Schmelzelektrolyse des Cyanids her. VorkommenKommerziell nutzbar ist nur das Mineral Pollucit, welches auch Pollux genannt wird und im Bernic Lake in Manitoba, Kanada abgebaut wird. Die Herstellung des reinen Metalls erfolgt durch Reduktion von Caesiumchlorid mit Calcium.
EigenschaftenCaesium weist von allen stabilen Elementen des Periodensystems mit 0,274 nm den größten Atomradius auf. Allgemein wenig bekannt ist, dass hochreines Caesium eine silberweiße Farbe aufweist. Bereits geringste Sauerstoffspuren, zum Beispiel aus dem Glas einer evakuierten Aufbewahrungsampulle, reichen aus, um den bekannten goldfarbenen Glanz des Metalls zu erzeugen. Die eigentliche Farbe des Metalls ist so nur für kurze Zeit nach seiner Destillation sichtbar. Caesium ist das weichste aller Metalle und äußerst dehnbar. Es hat nach Quecksilber und dem radioaktiven, in der Natur praktisch nicht vorhandenen Francium den niedrigsten Schmelzpunkt aller Metalle. Dieser liegt bei 28,45 °C, der Siedepunkt liegt bei 671 °C. Caesium ist nach Fluor das reaktionsfähigste stabile Element; es reagiert mit praktisch allen anderen Elementen. Bei der äußerst heftigen, stark exothermen Reaktion mit Wasser entsteht neben Wasserstoff auch noch Caesiumhydroxid, die absolut stärkste Metallhydroxidbase. In Luft verbrennt Caesium mit blauvioletter Flamme zu Caesiumhyperoxid. Oberhalb 300 °C greift es auch Glas an. Caesium ist auch das Element mit dem größten thermischen Ausdehnungskoeffizient (9,4 · 10-5 pro °C).
IsotopeNatürlich kommt nur 133Cs vor, es zählt somit zu den anisotopen Elementen beziehungsweise Reinelementen. Die anderen, allesamt radioaktiven Caesium-Isotope kommen nur als künstliche Spaltprodukte bei Kernreaktionen vor. Das bedeutendste künstliche Isotop ist der Beta- und Gammastrahler 137Cs mit einer Halbwertszeit von 30 Jahren. Bekannt wurde es vor allem durch die radioaktive Belastung nach dem Reaktorunglück von Tschernobyl 1986, wobei der anthropogen verursachte Eintrag in die Natur (hauptsächlich Böden) jedoch vorwiegend auf die oberirdischen Atomwaffentests der 50er und 60er Jahre zurückzuführen ist. Besonders angereichert hat es sich in bestimmten Pilzen (beispielsweise Maronenröhrlinge in Süddeutschland und Österreich) und in Wildtieren (maßgeblich Schwarzwild, in welchem sich auch heute noch bis zu 9000 Bq messen lassen (Süddeutschland, Schluchsee)). Der Grenzwert für Lebensmittel beträgt in der EU 600 Bq/kg. Verwendung
SicherheitshinweiseAn Luft entzündet sich Caesium spontan, weshalb es unter reinem Stickstoff oder Argon aufbewahrt werden muss. In Wasser reagiert es exotherm unter Entwicklung gasförmigen Wasserstoffs. Wegen seiner hohen Reaktionsfähigkeit reagiert es mit Wasser explosiv. Die Explosivität kann durch die Entzündung des dabei entstehenden Wasserstoffs verstärkt werden. VerbindungenCaesium ist eines der elektropositivsten Elemente. Aufgrund des großen Elektronegativitätsunterschieds zu den meisten anderen Elementen ist es fast ausschließlich in ionischen Verbindungen anzutreffen, wie zum Beispiel:
Andere Verbindungen sind z. B.:
BesonderheitIn gasförmigem Caesium ist die Brechzahl kleiner als 1. Das bedeutet, dass die Phasengeschwindigkeit der elektromagnetischen Welle - in diesem Fall Licht - größer als im Vakuum ist. Dieses Phänomen ist insbesondere von Plasmen her bekannt und steht in völligem Einklang mit der speziellen Relativitätstheorie, da weder Materie noch Information übertragen wird. Siehe auchGoiânia-Unfall – Diebstahl von Caesium-137 in den 1980-ern, das dann unter Freunden und Bekannten verteilt wurde.[5] Quellen
Videos
Kategorien: Feuergefährlicher Stoff | Ätzender Stoff | Alkalimetall | Periode-6-Element | Chemisches Element |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Caesium aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||